
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。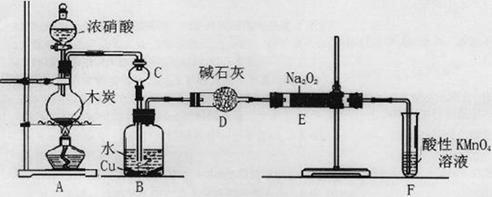
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
(1)有红棕色气体生成 (2分)
(2)3NO2+H2O=2H++2NO3-+NO↑(2分)3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O (2分)
(3)防止倒吸(2分) 吸收未反应的NO(2分) (4)Na2CO3 NaOH (2分)
(5)BE (2分) (6)69.0% (2分)
解析试题分析:(1)根据装置图可知,A中浓硝酸与木炭发生氧化还原反应生成CO2和NO2以及水,因此A中观察到的现象有红棕色气体生成。
(2)NO2溶于水生成NO和硝酸,硝酸具有氧化性能把金属铜氧化,则装置B中反应的离子方程式有3NO2+H2O=2H++2NO3-+NO↑、3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O。
(3)NO2极易溶于水与水反应,所以装置C的作用是防止倒吸;NO与过氧化钠反应后有剩余,随意排放容易引起大气污染,而NO能被酸性高锰酸钾溶液氧化,则装置F的作用吸收未反应的NO。
(4)生成的NO中含有CO2和水蒸气,二者均能与过氧化钠反应,而碱石灰可以吸收CO2和水蒸气,所以如果没有D装置,则E中产物除亚硝酸钠外还含有副产物Na2CO3、NaOH。
(5)KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,因此答案为BE。
(6)消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O可知,亚硝酸钠的物质的量是0.002mol×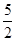 =0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×
=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×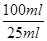 =0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数
=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数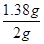 ×100%=69.0%。
×100%=69.0%。
考点:考查硝酸的性质、尾气处理、实验条件控制、实验方案设计与评价以及物质含量测定


科目:高中化学 来源: 题型:问答题
(15分)
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是 。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是 。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和 的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,
充分反应后,将液体和剩余气体分离,进行如下研究。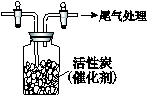
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl- ,证明无色液体是SO2Cl2。
① 写出SO2Cl2与H2O反应的化学方程式 。
② 检验该溶液中Cl-的方法是 。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
① 该白色沉淀的成分是 。
② 写出SO2与Cl2反应的化学方程式,并阐述理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分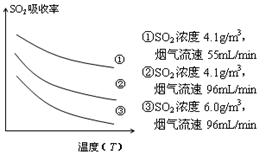
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。
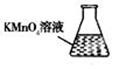

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)【化学——化学与技术】
工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。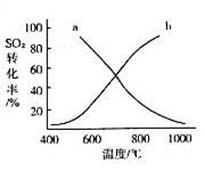
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。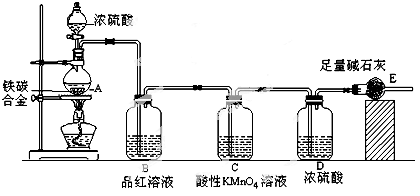
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是 ;C的作用是 。
(4)随着反应的进行,A中还可能发生某些离子反应,写出相应的离子方程式
反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是 ;
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写含m、b的表达式)。
(6)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是 (填写代号)。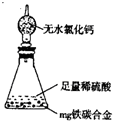
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。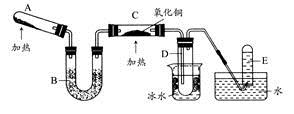
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题: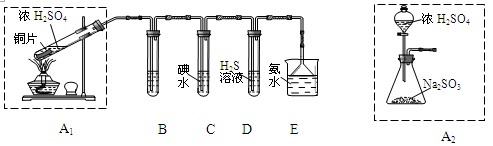
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。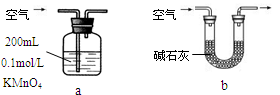
①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。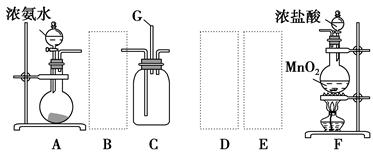
请回答下列问题:
(1)装置F中发生反应的离子方程式: 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰
B.生石灰
C.二氧化硅
D.五氧化二磷
E.烧碱
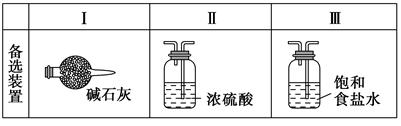
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E 。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理? 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10mL CH4,同温、同压下乙管中注入50mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。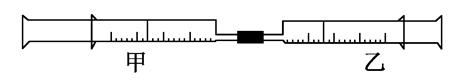
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。其中正确的是________。
(2)甲管中发生的化学反应类型为________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是_________
____________。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com