
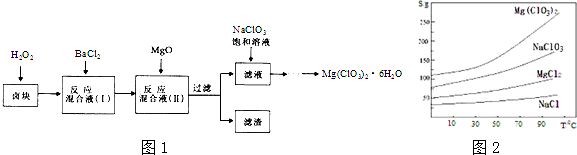
分析 卤块主要成分为MgCl2.6H2O,含有MgSO4、FeCl2等杂质,加入氧化剂过氧化氢氧化亚铁离子为铁离子,加入氯化钡溶液生成硫酸钡沉淀,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓过滤,得到Mg(ClO3)2溶液中,根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶制取Mg(ClO3)2•6H2O,
(1)过滤操用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有:漏斗、烧杯、玻璃棒;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来检验已沉淀完全;
(3)温度、固体颗粒大小、物质的浓度等会影响反应速率;
(4)根据加氧化镁后可以调节pH值,使溶液的pH为4,可以沉淀的离子来判断滤渣的主要成分;
(5)根据物质的溶解度大小,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥;
(6)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;
②根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量.
解答 解:(1)过滤的原理:过滤是把不溶于液体的固体物质跟液体分离开来的一种混合物分离的方法,过滤时需要制作过滤器的漏斗、滤纸、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯等,所以需要使用的玻璃仪器有烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,
故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)加入H2O2溶液的作用是使Fe2+氧化,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,
故答案为:使Fe2+氧化;调节溶液的pH,使Fe3+沉淀完全;
(4)加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子之间反应生成了硫酸钡沉淀,
故答案为:BaSO4和Fe(OH)3;
(5)根据物质的溶解度大小,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;
(6)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×$\frac{1}{6}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%,
故答案为:($\frac{1}{2}$×$\frac{1}{6}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,杂质离子的除杂原则和试剂选择,物质溶解度概念的应用,晶体析出的方法,是对学生综合能力的考查,题目难度中等.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 液氯、氯水、硫酸钠、乙醇 | ||
| C. | 空气、天然气、苛性钾、硫酸钡 | D. | 胆矾、漂白粉、氯化钾、氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1mol | |
| B. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| C. | 沉淀溶解转换的实质是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动 | |
| D. | △H<0,△S>0的反应一定是自发进行的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 →
→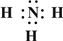 ,B的结构式为
,B的结构式为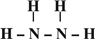 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中含有的阴离子数是0.2NA | |
| B. | 常温常压下,8gO2含有的电子数是4NA | |
| C. | 标准状况下,2.24LCCl4中含有分子数为0.1NA | |
| D. | 1L1.0mol•L-1Na2CO3溶液中含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com