
����˵����ȷ����( )
A. ij���ȷ�Ӧ���Է����У���˸÷�Ӧ��������Ӧ
B. �ö��Ե缫��⺬��H218O����ͨˮʱ���������ܲ���������Է���������ͬ��������
C. ��ӦA(g)  B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=- (Ea-Eb) kJ/mol
B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=- (Ea-Eb) kJ/mol
D. 3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ��������С��2x%����A����Ϊ�Ҵ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����б�Ӧ�ظ߶���ѧ��ѧҵˮƽ���ԣ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
14C�����ڿ��ţ���14����ָ
A. ������ B. ��������� C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и߶���ƽ�аࣩ3���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
±����C5H11Cl��C5H12O���ڴ���Ľṹ���ж����֣� ��
A. 5��3 B. 3��5 C. 10��8 D. 8��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�����и���ģ�⣨һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�絼���Ǻ����������Һ����������С����������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㡣��һ���¶��£���0.1mol/LKOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/L������ʹ�����Һ���ζ�������ͼ��ʾ�������й��ж���ȷ����
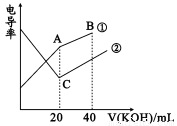
A. B�����Һ���У�c(K+)��c(OH-)>c(CH3COO-)>c(H+)
B. A�����Һ���У�c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C��ˮ�����c(OH-)����A��ˮ�����c(OH-)
D. A��B��C������Һ����Kw=c(H+)��c(OH-)=1.0��10-14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������и������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ������
������������Դ��Ҳ����Ҫ�Ļ���ԭ�ϣ����������������ⷽ��������������⣺
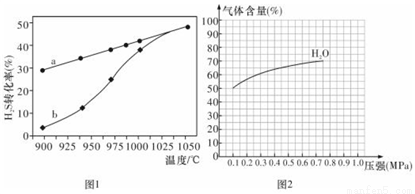
��1������һ��H2S�ȷֽⷨ����ӦʽΪ��H2S (g)  H2 (g)+S(g) ��H���ں����ܱ������У��ⶨH2S�ֽ��ת����(H2S����ʼŨ�Ⱦ�Ϊc mol/L)���ⶨ�����ͼ1����������a��ʾH2S��ƽ��ת�������¶ȹ�ϵ������b��ʾ��ͬ�¶��·�Ӧ������ͬʱ��δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ�
H2 (g)+S(g) ��H���ں����ܱ������У��ⶨH2S�ֽ��ת����(H2S����ʼŨ�Ⱦ�Ϊc mol/L)���ⶨ�����ͼ1����������a��ʾH2S��ƽ��ת�������¶ȹ�ϵ������b��ʾ��ͬ�¶��·�Ӧ������ͬʱ��δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ�
�١�H___________0���>����<����=������
����985��ʱ����Ӧ��t min�ﵽƽ�⣬��ʱH2S��ת����Ϊ40%����tmin�ڷ�Ӧ����v(H2)=______���ú�c��t�Ĵ���ʽ��ʾ����
����˵�����¶ȵ����ߣ�����b������a�ӽ���ԭ��_________________��
��2������������CaOΪ�����壬��������ʣ���C�ƣ���ˮ������Ӧ��ȡH2�������Ҫ��Ӧ���£�
I��C(s) + H2O (g) = CO (g) + H2(g) ��H = + 131.6 kJ/mol
II��CO (g) + H2O (g) = CO2 (g) + H2 (g) ��H = -43 kJ/mol
III��CaO(s) + CO2(g) = CaCO3(s) ��H = -178.3 kJ/mol
�ټ��㷴ӦC (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)�ġ�H=_____��������С�������1λ������K1��K2��K3�ֱ�Ϊ��ӦI��II��III��ƽ�ⳣ�����÷�Ӧ��ƽ�ⳣ��k=______����K1��K2��K3��ʾ����
�ڶ��ڿ��淴ӦC (s) +2H2O(g) +CaO(s)  CaCO3 (s)+2H2 (g)����ȡ���´�ʩ�������H2���ʵ���___�� ������ĸ��ţ�
CaCO3 (s)+2H2 (g)����ȡ���´�ʩ�������H2���ʵ���___�� ������ĸ��ţ�
A���ʵ��Ľ�����ϵ���¶� B��ʹ���������Ũ�Ⱦ��ӱ�
C������������������� D������CaO����
��ͼ2Ϊ��ӦI��һ���¶��£�ƽ��ʱ����������ٷֺ�����ѹǿ�仯�Ĺ�ϵͼ������Ӧ��ijһƽ��״̬ʱ�����c( H2O)=2c(H2)= 2c(CO)=2 mol��L���Ը���H2O������ٷֺ����仯���ߣ���������CO�ı仯����ʾ��ͼ��___________________
(3)��N2��H2Ϊ�缫��Ӧ���HCl-NH4C1Ϊ�������Һ��������ȼ�ϵ�أ��ŵ�����У���Һ��NH4+Ũ��������д���õ�ص�������Ӧʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
���ݹ����ð�ͭ�����ʳз���ߡ�з�˼�������Ҫ�ɷ���ͭ���Ͻ�Ni����CO�γ����������ε������Ni(CO)4��CuSO4���ڰ�ˮ�γ�[Cu(NH3)4]SO4����ɫ��Һ��
��1��Cu��̬ԭ�Ӻ�������Ų�ʽΪ________________��
��2��1 mol Ni(CO)4�к��ЦҼ�����ĿΪ_______________��
��3��[Cu(NH3)4]SO4�������ӵĿռ乹����___________����SO42-��Ϊ�ȵ�����ķ���Ϊ_______________�����ѧʽ��
��4�� NH3�ķе�_______________����ѡ����ڡ����ڡ���PH3��ԭ����_______________��
��5��ij��ͭ�Ͻ��ṹ����ͼ��ʾ.������ͭԭ������ԭ�ӵĸ�����Ϊ_______________��
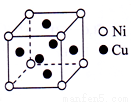
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£��� 0.1000 mol��L-1NaOH ��Һ�ζ� 20.00 mL 0.1000 mol��L-1�� CH3COOH ��Һ���õζ�������ͼ������˵����ȷ����
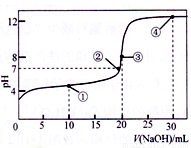
A. �����ʾ����Һ�У�c(Na+)+c(H+)��c(CH3COOH)+c(OH-)
B. �����ʾ��Һ�У�c(Na+)=c(CH3COO-)+c(CH3COOH)
C. �����ʾ��Һ�У�c(H+)=c(CH3COOH)+c(OH-)
D. �����ʾ��Һ�У�2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����и߶���ѧ��ѧҵˮƽ���ԣ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
ij������Ʒ���ܺ���NH4HCO3��NH4C1��NH4NO3�е�һ�ֻ��֡���ȡ����Ʒ1.000�ˣ�����ˮ���100 mL��Һ������Һ�ֳ����ȷ������������ʵ�飺
����һ����Һ�м���10 mL 0.2 mol.L-1��������֮��ַ�Ӧ�����ռ�����״���µ�CO2����44.8 mL���������CO2ȫ���ݳ�����
������һ����Һ�м���������6 mol.L-1����������Һ�����ȣ����������壨�������NH3ȫ���ݳ���������Ҫ25 mL 0.15mol.L-1��������ܱ���ȫ��Ӧ������˵����ȷ����
A. 1.000 g��Ʒ��һ������NH4HCO3 0.316��
B. ��ٷ�Ӧ���õ���Һ�м��������ữ����������Һ�����а�ɫ�������ɣ�˵��ԭ��Ʒ��һ������NH4C1
C. ԭ��Ʒ�ĺ�NH4+����������Ϊ21%
D. �������������ʵ����֤������ȷ��ԭ��Ʒ���Ƿ���NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ����3�¸߿�ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����пƬ�ʹ�ͭƬ��ͼʾ��ʽ����ͬŨ�ȵ�ϡ������һ��ʱ�䣬����������ȷ���� �� ��
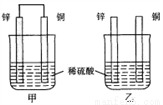
A. ���ձ�����Һ��pH������
B. ����ͭƬ������������ͭƬ�Ǹ���
C. ���ձ���ͭƬ����������ݲ���
D. �������ݵ��ٶȼױ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com