
【题目】在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。
请回答下列问题:
(1)化合物Cu(NH3)3(CO)Ac中,铜元素的化合价为___。
(2)该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序是___。
(3)写出基态Cu2+的电子排布式:___,向Cu2+的溶液中加入过量NaOH溶液,可生成Cu2+配位数为4的配位离子,写出该配位离子的结构式___。
(4)CO与N2互为等电子体,二者沸点较高的是___,理由是____。
(5)在一定条件下,NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子和氮原子的杂化轨道类型分别是:___和___。
(6)Cu与O形成的某种化合物的晶胞结构如图所示。
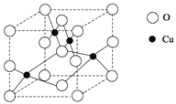
①在一个晶胞中,氧原子的数目为___。
②该化合物的化学式为____。
③晶胞的边长为apm,则该晶胞的密度为_____gcm-3。
【答案】+1 N>O>C 1s22s22p63s23p63d9 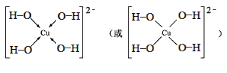 CO CO为极性分子,分子间作用力更强 sp2 sp3 4 CuO
CO CO为极性分子,分子间作用力更强 sp2 sp3 4 CuO ![]()
【解析】
(1)根据化合物结构,化合物中铜的化合价为+1价;
(2)该反应中第二周期元素有C、N、O三种元素,故三种元素的第一电离能从大到小为N>O>C;
(3)基态Cu2+的电子排布式为1s22s22p63s23p63d9;向Cu2+溶液中加入NaOH,可发生反应生成[Cu(OH)4]2-,其结构为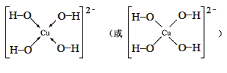 ;
;
(4)CO和N2互为等电子体,其中CO的沸点较高,原因是CO为极性分子,分子间作用力更强;
(5)尿素结构为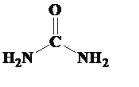 ,其中碳元素形成3个σ键,其杂化方式为sp2杂化;氮元素形成3个σ键,但是N原子本身还存在1对孤电子对,故N原子的杂化方式为sp3杂化;
,其中碳元素形成3个σ键,其杂化方式为sp2杂化;氮元素形成3个σ键,但是N原子本身还存在1对孤电子对,故N原子的杂化方式为sp3杂化;
(6)①根据晶胞结构,O占有晶胞的8个顶点、4个棱、2个面心和1个体心,故一个晶胞中有O原子![]() =4个;
=4个;
②晶胞内有4个Cu,故该晶胞的化学式为CuO;
③晶胞密度由晶胞质量除以晶胞体积计算,晶胞质量为![]() g,晶胞体积为(a
g,晶胞体积为(a![]() 10-10)3 cm3,故晶胞密度为
10-10)3 cm3,故晶胞密度为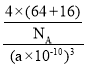 =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3是一种剧毒物,可加入祛毒剂SnCl2来除去,反应方程式为:2H3AsO3+3SnCl2+12X=2As↓+3H2SnCl6+6H2O。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.X的化学式为HCl,是该反应的氧化剂
C.每生成0.2molAs,还原剂得到0.6mol电子
D.该反应转移2mol电子,则消耗祛毒剂SnCl2为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求作答:
(1)请根据官能团的不同对下列有机物进行分类:
① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]()
Ⅰ.酚:________酮:________醛:________(填序号);
Ⅱ.④的官能团的名称为______、⑦的官能团的名称为______;
(2)分子式为C4H8且属于烯烃的有机物的同分异构体(不考虑顺反异构)有 ____种; 高聚物的单体的结构简式是_________。
高聚物的单体的结构简式是_________。
(3)![]() 的名称为:_____________;写出
的名称为:_____________;写出![]() 聚合生成高分子化合物的化学方程式__________________________________;
聚合生成高分子化合物的化学方程式__________________________________;
(4)键线式![]() 表示的分子式为___________;与其互为同分异构体且一氯代物有两种的烃的结构简式____________________;
表示的分子式为___________;与其互为同分异构体且一氯代物有两种的烃的结构简式____________________;
(5)篮烷分子的结构如图所示:
![]()
①篮烷的分子式为:________,其一氯代物有______种;
②若使1mol该烃的所有氢原子全部被氯原子取代,需要_____mol氯气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液为无色,请回答:
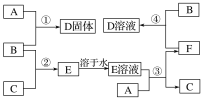
(1)A是__________,B是__________,C是_______________(填写化学式)。
(2)反应①的化学方程式为_______________________________。
(3)反应③的化学方程式为________________________________________。
(4)反应④的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
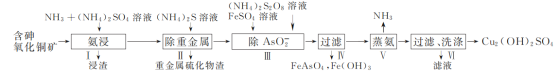
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
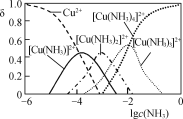
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 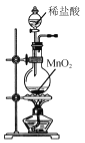 制取Cl2
制取Cl2
B. 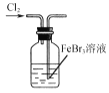 使Br-转化为Br2
使Br-转化为Br2
C. 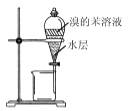 分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:
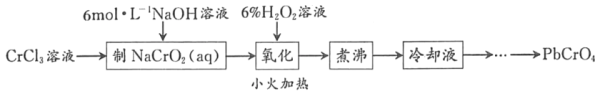
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
③六价铬在溶液中物种分布分数与pH关系如图2所示。
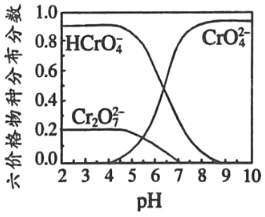
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池发电站,与普通火力发电站相比,其有害物排放少,运行噪音低,被誉为“绿色”发电站。如图为某空气燃料电池工作原理,下列说法错误的是
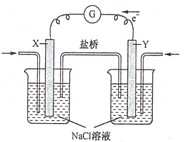
A.该电池工作时,X电极附近的溶液pH升高
B.该电池工作时,盐桥中的阴离子向Y电极移动
C.若用甲醇作燃料,则X电极上的反应为CH3OH-6e-+H2O=CO2+6H+
D.若用甲烷作燃料,当电路中通过0.8mol电子时,则消耗甲烷的质量为1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com