
【题目】下列实验正确的是
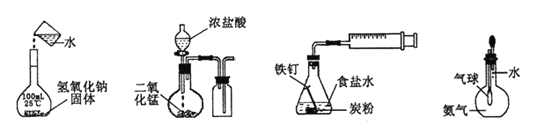
A.配制一定浓度溶液B.制取并收集Cl2C.铁的析氢腐蚀D.验证氨气易溶于水
【答案】D
【解析】
A.配制一定浓度溶液时,图中代表的是移液步骤的操作,不能直接将烧杯中的NaOH溶液倒入100mL容量瓶中,必须使用玻璃棒引流,故A项错误;
B.制取并收集氯气时,应根据反应物的状态和反应条件决定制取方法和装置,根据气体的性质确定收集方法,二氧化锰固体和浓盐酸混合加热才能反应,图中缺少酒精灯等加热用品,氯气的密度比空气大,不能用向下排空气法收集,因此图中短进长出排空气不能收集氯气,应改为长进短出排空气,故B项错误;
C.铁比碳活泼,铁是负极,碳是正极,NaCl是强酸强碱盐,其溶液显中性,因此铁钉发生吸氧腐蚀,不能发生析氢腐蚀,故C项错误;
D.若气球体积快速或明显增大,说明大气与瓶内气体存在较大的压强差,原因只能是瓶内气体体积迅速减小,说明氨气极易溶于水,故D项正确;
故答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题:
(1)放电时,负极材料是___;电解液中H2SO4的浓度将变___(选“变大”“变小”或“不变”);
(2)充电时,阳极的电极反应式是___。
II.如图是一个化学过程的示意图。

(1)图中甲池是___装置(填“电解池”或“原电池”),其中K+移向___极(选“正”或“负”)
(2)乙池中石墨电极A上发生的电极反应式:___。
(3)若丙内为足量NaCl溶液,当甲池内通入11.2LO2(标准状况下),则丙池中产生的气体的体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
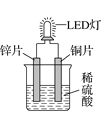
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.其能量转化的形式主要是“化学能→电能→光能”
C.如果将锌片换成铁片,电路中的电流方向将改变
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应:2A(s)+2B(g)![]() C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混和气体的平均相对分子质量不再改变
B.混和气体的密度不随时间而变化
C.容器内的压强不随时间而变化
D.A的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当反应A(s)+2B(g)![]() C(g)+D(g)达到平衡状态后,下列哪些物理量不再发生变化,
C(g)+D(g)达到平衡状态后,下列哪些物理量不再发生变化,
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数)( )
A.124gP4含有P—P键的个数为6NA
B.24g石墨中含有六元环个数为3NA
C.46g乙醇中含有极性键的个数为6NA
D.18g冰中含氢键的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。一定条件下,CO与H2合成燃烧的热化学方程式为:CO(g)+3H2(g)=CH4(g)+H2O(l) △H,则△H=___;该反应能自发进行的原因是___。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①一定温度下,在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A,开始时容器体积为2 L,CO和CH3OH(g)的浓度随时间变化如图1所示,10 min时达到平衡,则反应A的化学平衡常数为_______。(结果保留一位小数)。
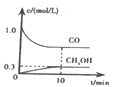
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应B已经达到平衡状态的是___(填序号)。
A. 容器内CO2的体积分数不再变化
B. 当CO2和H2转化率的比值不再变化
C. 当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H健
D. 容器内混合气体的平均相对分子质量达到34.5,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )

A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com