
某晶体水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A、KSCN B、NH4SCN C、NH4Cl D、FeCl3
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:阅读理解
| X |
| X |
| H2O |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 现象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 现象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为亮绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 180Va |
| W |
| 180Va |
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:
草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:| V |
| 10 |
| V |
| 10 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈三中高二上学期期中考试化学试卷(带解析) 题型:实验题
(20分)草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为 请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
(3)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)______________________________。
a.托盘天平(带砝码,镊子) b.酸式滴定管 c.碱式滴定管 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
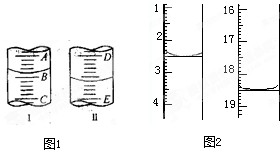
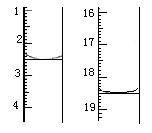
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。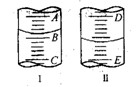
| A.是amL | B.是(25-a)mL | C.一定大于amL | D.一定大于(25-a)mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com