
【题目】下列各组离子在溶液中能大量共存的是
A. Al3+、Cl-、Ca2+ B. Mg2+、SO42-、OH-
C. Na+、SO32-、H+ D. Fe3+、SCN-、K+
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法中正确的是
A. 乙苯的同分异构体有三种
B. 丙烯与溴的四氯化碳溶液反应能生成BrCH2CH2CH2Br
C. 己二酸(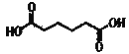 )可以发生氧化反应、取代反应、加聚反应
)可以发生氧化反应、取代反应、加聚反应
D. 有机物 分子中所有碳原子不可能共平面
分子中所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。实验室用氯化钠、废铁屑、稀硫酸、氢氧化钾溶液等为原料,通过以下过程制备高铁酸钾(K2FeO4):

(l) Na2O2的电子式为__________。
(2)操作I的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、隔绝空气减压干燥.其中隔绝空气减压干燥的目的是_______。
(3)气体X为____,写出FeSO4与Na2O2反应的化学方程式:________。
(4)最终在溶液中可得到K2FeO4 晶体的原理是_________。
(5)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
(6)称取提纯后的K2FeO4样品0.2100g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL 溶液,取出25.00 mL放入锥形瓶,用0.0l000mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00mL。涉及的主要反应为:Cr(OH)4-+FeO42-=Fe(OH)3+CrO42-+OH-
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入3mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.100 mL
B.45 mL
C.10 mL
D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种常见的强酸,下列关于浓、稀硝酸的描述错误的是( )
A.浓硝酸氧化性大于稀硝酸
B.浓硝酸导电性小于稀硝酸
C.浓硝酸能使铝、铁钝化,稀硝酸不能
D.与铜反应的氧化产物两者相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO![]() 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com