
| A. | X- | B. | 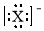 | C. | 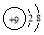 | D. | 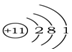 |
科目:高中化学 来源: 题型:解答题
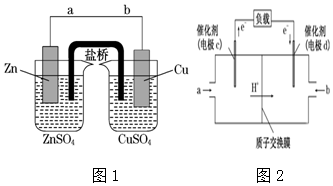
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NaCl中含有Na2CO3,加水溶解 | |
| B. | 鉴别NaCl和Na2CO3溶液,加适量盐酸 | |
| C. | 除去CaO中的CaCO3,加足量稀盐酸 | |
| D. | 除去CO2中少量的CO,通入O2,点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol CaC2中有3NA个离子 | |
| B. | 1mol SiO2中含有2NA个共价键 | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
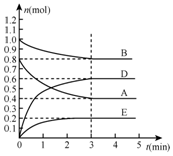 在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).
在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
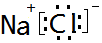 .
.| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com