
【题目】雾霾是对空气中各种悬浮颗粒物含量超标的笼统表述,而氮氧化物是造成酸雨和光化学烟雾的罪魁祸首之一,工业上在一定温度和催化剂条件下,NH3可用于消除NO的污染,生成一种无害气体。
(1)悬浮颗粒物可用高压电除去,利用了________________现象。
(2)实验室制备氨气的原理:_________________________(用化学方程式表示)。反应发生、气体收集和尾气处理的装置依次为_______(填序号)。

(3)实验室也可采用下图所示装置制取氨气。烧瓶内可选用______________(填序号)。

A.NaOH固体 B.无水氯化钙 C.二氧化硅 D.碱石灰
(4)按下图装置进行NH3性质实验。

①先打开旋塞1,B瓶中的现象是_____________________,原因是______________________,稳定后,关闭旋塞1。
②再打开旋寒2,B瓶中的现象是_____________________________。
(5)请写出NH3与NO2反应的化学方程式:_______________________。该反应中每生成1nolN2转移的电子数____________________(结果保留1位小数)。
【答案】 电泳 2NH4Cl+Ca(OH)2![]() 2NH3↑+ CaCl2+2H2O ACG AD 有白烟出现 因A瓶中HCl气体压强大,所以HCl进入B瓶,与NH3发生反应,生成白色NH4Cl固体颗粒 石蕊水溶液进入B瓶,且溶液显红色 6NO2+8NH3
2NH3↑+ CaCl2+2H2O ACG AD 有白烟出现 因A瓶中HCl气体压强大,所以HCl进入B瓶,与NH3发生反应,生成白色NH4Cl固体颗粒 石蕊水溶液进入B瓶,且溶液显红色 6NO2+8NH3![]() 7N2+12H2O 3.4NA
7N2+12H2O 3.4NA
【解析】(1)在电场作用下,胶体中的颗粒会向某一个电极定向移动,然后聚集为大颗粒转化为沉淀,所以是电泳。
(2)实验制备氨气是用氯化铵和氢氧化钙的固体混合加热,反应为2NH4Cl+Ca(OH)2![]() 2NH3↑+ CaCl2+2H2O。制备气体的装置同实验室制氧气,所以选A。氨气的密度小于空气,所以收集装置选C。最后要防倒吸,所以选G(漏斗边缘紧贴水面)。
2NH3↑+ CaCl2+2H2O。制备气体的装置同实验室制氧气,所以选A。氨气的密度小于空气,所以收集装置选C。最后要防倒吸,所以选G(漏斗边缘紧贴水面)。
(3)制氨气也可以选择将氨水滴加到氢氧化钠、氧化钙或者碱石灰固体上,所以答案为AD。
(4)①先打开旋塞1,因为A中压强更大,所以A中HCl气体会进入B中与NH3反应得到氯化铵白烟。②再打开旋寒2,因为B中气体反应生成氯化铵固体,所以压强下降,石蕊水溶液被压入B中,且因为氯化铵水解显酸性,所以溶液变为红色。
(5)NH3与NO2反应的化学方程式为:6NO2+8NH3![]() 7N2+12H2O电子转移数为24e-,所以生成1mol氮气时,转移电子为24/7=3.4mol,即3.4NA。
7N2+12H2O电子转移数为24e-,所以生成1mol氮气时,转移电子为24/7=3.4mol,即3.4NA。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.含金属元素的离子一定都是阳离子
B.金属阳离子被还原不一定得到金属单质
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属原子失电子越多,其还原性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 镁着火时可用二氧化碳灭火器灭火
B. 现代化学分析测试中,常借助一些仪器来分析化学物质的组成。如用原子吸收光谱确定物质中含有哪些金属元素
C. 生物炼铜就是利用特殊的细菌将硫化铜转化为铜
D. 二氧化硅的化学性质不活泼,能与强碱反应,不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②碘与CCl4溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于( )
A. 化合反应 B. 复分解反应 C. 分解反应 D. 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制备少量高氯酸。该学习小组查阅到:a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;c.NaClO3 在673K(400℃)分解产生NaClO4、NaCl和一种气体。该小组同学设计实验分三步制备高氯酸;(一)制氯气并使制得的氯气与氢氧化钠溶液反应制氯酸纳;(二)氯酸钠分解制高氯酸钠;(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓) ![]() Na2SO4+2HClO4 ]。
Na2SO4+2HClO4 ]。
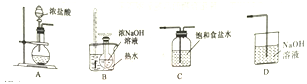
(1)制取氯酸钠的装置连接顺序为A,____________。由装置可知该小组制氯气时采用的氧化剂可以为___________(填化学式)。
(2)B装置中发生反应的离子方程式为_________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:

该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13 g,加热充分反应后集气瓶中收集到224 mL(标准状况下)气体,则该反应的化学方程式为_____________________;不选用乙装置的原因可能为____________________。
(4)用丙装置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。实验开始前,胶塞及导管接口需要包锡箔纸,其原因是_________________,仪器E的名称为________。该组同学发现操作中少加入一种物质,该物质的名称为________。发现后的正确操作为_____________。
(5)工业上大量制备NaClO4 常用高电流密度电解NaClO3 的方法,试写出以惰性电极电解时的阳极反应式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com