
| A、2a=c-d-2b |
| B、a=c-d-2b |
| C、2a=c+d-2b |
| D、a=c+d-b/2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:

| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
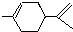 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式为C10H16 |
| B、常温下为液态,难溶于水 |
| C、属于芳香烃 |
| D、1mol该物质与1molHCl加成所得产物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将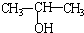 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸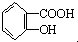 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备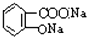 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO、H2的浓度都比原平衡时的要小 |
| B、CO、H2的浓度都比原平衡时的要大 |
| C、H2、H2O(g)的浓度都比原平衡时的要大 |
| D、CO、H2O(g)的浓度都比原平衡时的要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,当弱酸的浓度相同时,电离常数越大,酸性越强 |
| B、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0×10-7mol?L-1 |
| B、1.0×10-6mol?L-1 |
| C、1.0×10-12mol?L-1 |
| D、1.0×10-14mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com