
| m |
| V |
| m |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
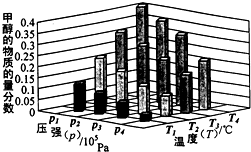 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省金华十校高考模拟考试理综化学试卷(解析版) 题型:填空题
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-???????????????? 。
②该反应在低温下能自发进行,该反应的ΔH ????????? 0。(选填“>”、“<”)
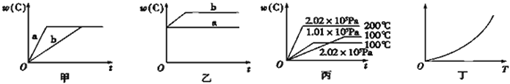
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。

则下列说法不正确的是????????? 。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①
②
③
①△H3和△H1、△H2的关系为△H3=???????????? 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。

③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
 xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t) 的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t) 的关系。 
查看答案和解析>>
科目:高中化学 来源: 题型:
A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则___________曲线表示无催化剂时的情况,原因是______________________________。
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则_________曲线表示恒温恒容的情况,原因是__________________。
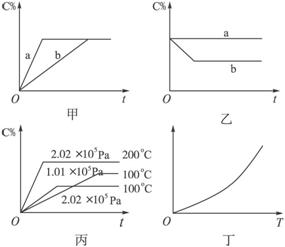
(3)根据丙图可以判断该可逆反应的正反应是_________热反应,计量数x的值_________。
(4)丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随着温度T的变化情况,根据你的理解,丁图的纵坐标可以是___________,原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com