
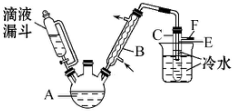
 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
分析 (1)在浓硫酸、加热条件下,乙醇可以发生消去反应生成乙烯,也可以发生分子间脱水生成醚,浓硫酸具有强氧化性可以氧化得到溴单质,反应会有水生成,反应中会放出大量的热,容易使HBr挥发等;
(2)溴化氢与浓硫酸加热时发生氧化还原反应生成二氧化硫、溴单质和水;
(3)加热时加快反应速率蒸出溴乙烷;
(4)通过E的末端插入水面以下冷却减少溴乙烷的挥发;
(5)根据溴乙烷和溴的性质,逐一分析能够和溴反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(6)洗涤需要在分液装置中进行,依据分液需要的仪器分析判断.
解答 解:(1)在浓硫酸、加热条件下,乙醇可以发生消去反应生成乙烯,也可以发生分子间脱水生成醚,浓硫酸具有强氧化性可以氧化得到溴单质,反应会有水生成,反应中会放出大量的热,容易使HBr挥发等,故制备操作中,加入的浓硫酸必需进行稀释,其目的是:减少副产物烯和醚的生成,减少Br2的生成,减少HBr的挥发,
故选:abc;
(2)溴化氢与浓硫酸加热时发生氧化还原反应生成二氧化硫、溴单质和水,反应的化学方程式为:2HBr+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ SO2+Br2+2H2O;
故答案为:2HBr+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ SO2+Br2+2H2O;
(3)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来;
故答案为:加快反应速率,蒸馏出溴乙烷;
(4)导管E的末端须在水面以下,通过冷却得到溴乙烷,减少溴乙烷的挥发,所以原因是通过冷却得到溴乙烷,减少溴乙烷的挥发;
故答案为:通过冷却得到溴乙烷,减少溴乙烷的挥发;
(5)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.氯化钠和溴单质、溴乙烷都不反应,故B错误;
C.除去溴乙烷中的少量杂质Br2,加碘化亚铁会引入碘单质杂质,故C错误;
D.加亚硫酸钠只与溴反应不与溴乙烷反应,故D正确;
故选D;
(6)洗涤产品分离混合物需要在分液装置中,需要的仪器为分液漏斗,烧杯,遵循“上吐下泻”原则;
故答案为:分液漏斗、烧杯.
点评 本题考查了物质制备的反应原理和过程分析,物质性质的应用和装置的特征应用是解题关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
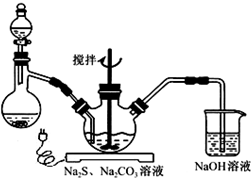 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: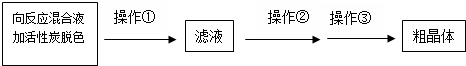
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 在多能源时期,氢能、生物质能等的核心仍然是化学反应 | |
| D. | 核能、太阳能的利用取决于新型材料的合成与开发 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com