
 X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2. 分析 Z为发酵粉的主要成分之一,应为NaHCO3,E为酸性气体,应为CO2,由转化关系可知X为NaOH,Y为Na2CO3,工业在氨气饱和的氯化钠溶液中通入二氧化碳制备NaHCO3,以此解答该题.
解答 解:Z为发酵粉的主要成分之一,应为NaHCO3,俗称小苏打,E为酸性气体,应为CO2,由转化关系可知X为NaOH,Y为Na2CO3,工业在氨气饱和的氯化钠溶液中通入二氧化碳制备NaHCO3,因氨气易溶于水,二氧化碳微溶于水,制备碳酸氢钠时,工业在氯化钠饱和溶液中先通入氨气,再通入二氧化碳,
故答案为:小苏打;饱和氯化钠溶液;NH3;CO2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:AsH3>H2S>HC1 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量 时间 | n(X)/mol | n(Y)/mol | n(M)/mol | n(N)/mol |
| 0 | 2.0 | 1.0 | 1.0 | 1.0 |
| 10min | 1.0 | 2.0 | 3.0 | 4.0 |
| 20min | 0.5 | 2.5 | 4.0 | 5.5 |
| 30min | 0.25 | 2.75 | 4.5 | 6.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
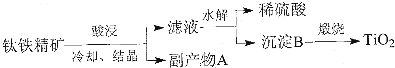
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2CO2═2Na2CO3+O2 | |
| B. | Ca(O H)2+2NH4Cl=CaCl2+2NH3↑+2H2O | |
| C. | Fe2O3+3CO $\frac{\underline{\;加热\;}}{\;}$2Fe+3CO2 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com