
| A、2.4克Mg由原子变为离子,共失去的电子数为0.1NA |
| B、1.7克H2O2中所含有的电子数为0.9NA |
| C、相同质量的NO2和N2O4所含的原子数不同 |
| D、在20℃,1.01×105Pa时,11.2L O2与H2的混合气体所含原子数为NA |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
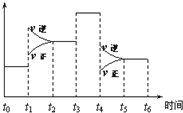 一密闭体系中发生反应:2SO2(g)+O2(g)?2SO3(g),如图表示该反应的速率(v)在某一时间(t)段内的变化.则下列时间段中,SO3的百分含量最高的是( )
一密闭体系中发生反应:2SO2(g)+O2(g)?2SO3(g),如图表示该反应的速率(v)在某一时间(t)段内的变化.则下列时间段中,SO3的百分含量最高的是( )| A、t0→t1 |
| B、t2→t3 |
| C、t3→t4 |
| D、t5→t6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素金属性:B>A;元素非金属性:D>C |
| B、原子半径:A>B>C>D |
| C、离子半径:D(n+1)->C n->B (n+1)+>A n+ |
| D、原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| B、100mL 2 mol/L的NaCl溶液中含NaCl分子数为0.2NA |
| C、常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| D、标准状况下,22.4L过氧化氢中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是表示物质质量的单位 |
| B、10g氟化氢含有0.5molHF分子 |
| C、1g氢气的物质的量是1mol |
| D、物质的摩尔质量等于其式量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中发生物质变化的同时,一定发生能量变化 |
| B、△H>0表示放热反应,△H<0表示吸热反应 |
| C、△H的大小与热化学方程式中化学计量数无关 |
| D、生成物释放的总能量大于反应物吸收的总能量时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 10 |
| 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com