
| A. | 0.25mol | B. | 0.30mol | C. | 0.35mol | D. | 0.4mol |
分析 物质的量均为0.1mol K2SO4和Al2(SO4)3溶于水,溶液中含有0.2mol铝离子、0.4mol硫酸根离子;留在溶液中的铝元素可能为铝离子或偏铝酸根离子,分别根据反应方程式计算出加入氢氧化钡的物质的量,再根据硫酸根离子的物质的量计算出生成硫酸钡沉淀的物质的量.
解答 解:将物质的量均为0.1mol K2SO4和Al2(SO4)3溶于水,溶液中含有0.2mol铝离子、0.4mol硫酸根离子,
①当反应后的溶液中铝元素以铝离子形式存在时,加入的氢氧化钡不足,则反应生成氢氧化铝的铝离子为0.1mol,根据反应3OH-+Al3+=Al(OH)3↓可知,反应消耗氢氧根离子的物质的量为0.3mol,加入氢氧化钡的物质的量为:0.3mol×$\frac{1}{2}$=0.15mol,硫酸根离子有0.4mol,则反应生成硫酸钡的物质的量为0.15mol,
②当加入氢氧化钡过量时,溶液中铝元素以偏铝酸根离子形式存在,则反应生成了0.1mol氢氧化铝和0.1mol偏铝酸根离子,根据反应3OH-+Al3+=Al(OH)3↓、4OH-+Al3+=AlO2-+2H2O可知,反应消耗氢氧根离子的物质的量为:0.1mol×3+0.1mol×4=0.7mol,加入氢氧化钡的物质的量为:0.7mol×$\frac{1}{2}$=0.35mol,而硫酸根离子有0.4mol,则反应最多生成0.35mol硫酸钡沉淀,
根据以上计算可知,生成硫酸钡的物质的量可能为:0.15mol或0.35mol,
故选C.
点评 本题考查混合物反应的相关计算,题目难度中等,试题侧重考查学生全面分析问题的能力,因氢氧化铝的两性,要注意分析氢氧化铝沉淀先生成后溶解现象,为易错点.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给烧瓶加热时,要垫上石棉网 | |
| B. | 给试管里的液体加热,液体体积不超过试管容积的三分之一 | |
| C. | 用托盘天平称量氢氧化钠固体时,应该放在小烧杯里称量 | |
| D. | 酒精灯打翻用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2和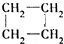 | B. | CH3CH2CH2CH3和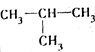 | C. | CH3Cl和CH3CH2Br | D. | CH3OH和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
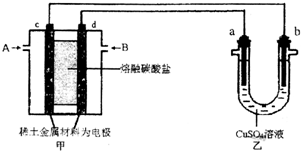
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、HCO3- | B. | Na+、Fe2+、Cl-、OH- | ||
| C. | NH4+、CO32-、NO3-、Ba2+ | D. | Cu2+、Fe3+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、S2-、H+、SO42- | B. | H+、NO3-、Ba2+、Mg2+ | ||
| C. | Na+、Cl-、H+、SO42- | D. | Ba2+、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①⑤ | B. | 只有②④ | C. | 只有③⑥ | D. | 只有④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com