
分析 (1)该反应中,Cl元素化合价由0价变为-1价,C元素化合价由+2价变为+4价,据此判断被氧化的元素;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3;
(3)计算废水中KCN的质量,再根据n=$\frac{m}{M}$计算KCN的物质的量,使KCN完全转化为无毒物质,生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,根据电子转移守恒计算n(Cl2),再根据m=nM计算需要氯气的质量.
解答 解:(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化,
故答案为:C;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O.
(3)废水中KCN的质量为650mg/L×20×103L=13×103g,物质的量为$\frac{13000g}{65g/mol}$=200mol,使KCN完全转化为无毒物质,应生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=200mol×(4-2)+200mol×[0-(-3)],解得n(Cl2)=500mol,故需要氯气的质量为500mol×71g/mol=35500g=35.5kg,
故答案为:35.5.
点评 本题综合考查学生的分析能力和计算能力,注意把握元素化合价的判断,为解答该题的关键,结合电子得失守恒解答该题,难度中等.


科目:高中化学 来源: 题型:选择题
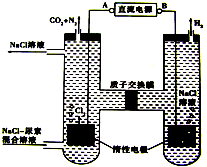
| A. | B是电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将增大 | |
| C. | 阳极室中发生的电极反应为:2Cl--2e-=Cl2↑ | |
| D. | 阳极室中发生的反应为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
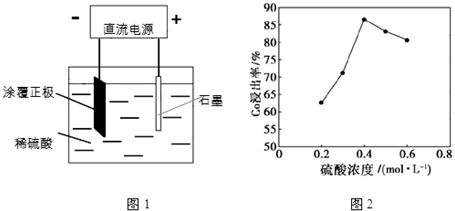
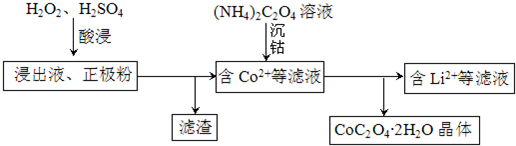
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4 | B. | CH2Cl2 | C. | NH3 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PVC保鲜膜属于链状聚合物,在高温时易熔化 | |
| B. | PVC的单体不能由PE的单体与氯化氢加成制得 | |
| C. | 鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE | |
| D. | 等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
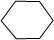 ,名称是环己烷.
,名称是环己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应需在300℃进行可推测该反应是吸热反应 | |
| B. | 使用催化剂可大大提高生产效率 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
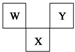 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物是强酸,气态氢化物是弱碱 | |
| C. | X元素的氧化物水溶液呈强酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com