
| A、水的电离程度始终增大 | ||
B、
| ||
| C、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
| c(H+)?c(NH3?H2O) | ||
c(N
|
| c(NH4+) |
| c(NH3?H2O) |
c(OH-)?c(N
| ||
| c(NH3?H2O) |
| c(NH4+) |
| c(NH3?H2O) |
| c(NH4+) |
| c(NH3?H2O) |


科目:高中化学 来源: 题型:
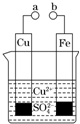 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、a和b用导线连接时,铁片上发生还原反应 |
| B、a和b不连接时,铁片上会有金属铜析出 |
| C、a和b用导线连接时,电流由a经导线流向b,溶液中SO42-流向Fe电极 |
| D、无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
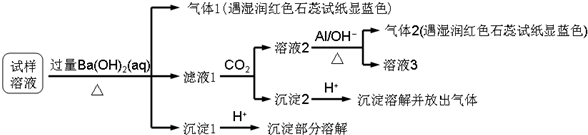
| △ |
| A、试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B、试样中一定不含Al3+ |
| C、试样中可能存在Na+、Cl- |
| D、该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强 |
| B、N、O、F最高正价依次升高,对应的气态氢化物的稳定性依次增强 |
| C、第三周期元素的原子半径中,位于ⅦA族元素的最小 |
| D、Na、Mg、Al三种元素对应的氢氧化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
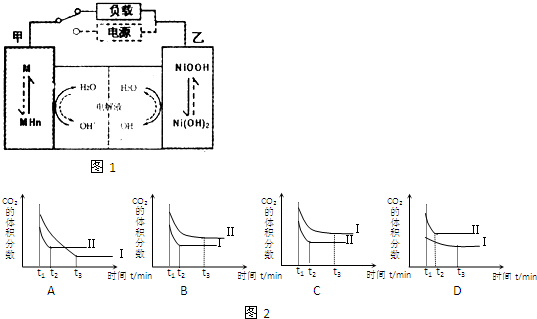
| 放电 |
| 充电 |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | v正和v逆比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-4 | v正=v逆 |
| Ⅱ | 1.0×10-3 | 4.0×10-4 | 5.0×10-4 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com