
| A. |  用图所示装置除去乙烯中少量SO2气体 | |
| B. |  用图装置量取20.00 mL 0.10 mol•L-1硫酸 | |
| C. |  用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 | |
| D. | 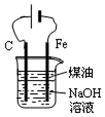 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
分析 A.乙烯、二氧化硫均能被高锰酸钾氧化;
B.图中为碱式滴定管;
C.CH3COOC2H5和饱和碳酸钠溶液分层;
D.Fe与负极相连,为阴极,不能失去电子.
解答 解:A.乙烯、二氧化硫均能被高锰酸钾氧化,不能除杂,应选NaOH溶液,故A错误;
B.图中为碱式滴定管,不能量取20.00 mL 0.10 mol•L-1硫酸,应选酸式滴定管,故B错误;
C.CH3COOC2H5和饱和碳酸钠溶液分层,可利用图中分液装置分离,故C正确;
D.Fe与负极相连,为阴极,不能失去电子,不能制备,Fe应连接正极,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、仪器使用、电解原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 有浓硫酸参与的反应都是氧化还原反应 | |
| B. | 硫在足量空气中燃烧生成大量SO3 | |
| C. | SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 | |
| D. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL10 mol•L-1的浓盐酸与足量的MnO2反应 | |
| B. | 2molCu与200g98%的浓硫酸反应 | |
| C. | 65gZn与足量的硝酸反应 | |
| D. | H2O(g)和CO2混合气体2mol与足量的Na2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 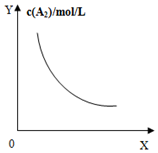 对于反应:A2(g)+3B2(g)?2AB2(g),图①中的横轴x可以表示压强 | |
| B. | 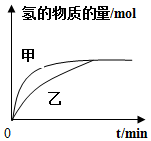 如图表示其他条件相同时,甲、乙两份等质量锌粉分别与足量稀硫酸反应,甲中加入少量铜粉 | |
| C. |  如图可表示乙酸溶液中通入氨气至过量时溶液导电性的变化 | |
| D. |  据图,若除去0.1mol•L-1CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 沸点:XW2>Y2W | |
| C. | 最高价氧化物对应的水化物的酸性:X>Z | |
| D. | 简单氢化物的热稳定性:Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| C. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通人H2S,有黄色沉淀 | |
| B. | 加入铜粉,溶液变为蓝色 | |
| C. | 加人锌粉,溶液棕黄色逐渐消失 | |
| D. | 滴加NaHCO3溶液,有气体和红棕色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| C. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | |
| D. | 当电池中消耗0.02g H2时,a极周围会产生0.02gH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com