
| A. | H2O | B. | I2 | C. | NH4Cl | D. | CaCl2 |
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 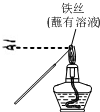 用装置甲检验溶液中是否有K+ | B. |  用装置乙制取并收集少量NH3 | ||
| C. |  用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸中加入过量铜片 | B. | Ca(OH)2溶液中通入Cl2 | ||
| C. | FeCl3溶液中加入过量铜片 | D. | AlCl3溶液中通入过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | B. | 升高温度可减小反应速率 | ||
| C. | 达到平衡时,v(正)=v(逆)=0 | D. | 达到平衡时,NO2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com