
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲组 | c(HA)=0.2mol/L | c(NaOH)=0.2mol/L | pH=a |
| 乙组 | c(HA)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丙组 | pH=2 | pH=12 | pH=b |
分析 (1)甲组中c(HA)=0.2mol/L和c(NaOH)=0.2mol/L等体积混合恰好完全反应生成NaA,根据溶液是否能水解来判断;
(2)乙组中c(HA)=0.1mol/L,c(NaOH)=0.1mol/L等体积混合恰好完全反应生成NaA,溶液pH=9,说明HA是弱酸;
(3)HA为弱酸,反应前酸的浓度大于氢氧化钠浓度,则混合液中酸过量,溶液呈酸性.
解答 解:(1)甲组中c(HA)=0.2mol/L和c(NaOH)=0.2mol/L等体积混合恰好完全反应生成NaA,如果是强酸强碱盐溶液的pH=7,说明HA为强酸;如果是弱酸强碱盐溶液的pH>7,HA为弱酸,故答案为:=;>;
(2)乙组中c(HA)=0.1mol/L,c(NaOH)=0.1mol/L等体积混合恰好完全反应生成NaA,溶液pH=9,说明HA是弱酸,所以离子浓度的大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(3)pH=2的HA溶液中,由于HA为弱酸,则HA的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,则HA的浓度大于氢氧化钠溶液的浓度;混合液中酸过量,溶液呈酸性,则溶液的pH=b<7,
故答案为:>;<.
点评 本题考查较为综合,涉及了盐类水解、强弱电解质的判断、电荷守恒等知识,有一定的综合性,为高考常见题型,题目难度中等,侧重于学生的分析能力和计算能力的考查,该题的命题方式为高考命题的热点.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 参加反应的CO2的体积为0.224 a L | |
| B. | 若a=b,则CO2与NaOH溶液反应的产物中盐只有Na2CO3 | |
| C. | b可能等于a、小于a或大于a | |
| D. | 不能确定NaOH溶液的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 | |
| D. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 能量关系 |
| A | 将盛“NO2玻璃球”置热水中,红棕色加深 | N2O4(g)?2NO2(g) △H<0 |
| B | NaOH与HCl溶液混合,溶液温度升高 | 反应物的能量>生成物的能量 |
| C | 钠投入水中,熔化成小球 | 反应物的能量<生成物的能量 |
| D | 微热含酚酞的Na2CO3溶液,溶液红色加深 | CO32-+H2O?HCO3-+OH-△H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的 |
| A | 向酸性KMnO4溶液中滴加草酸溶液,观察紫色是否消失 | 验证草酸具有还原性 |
| B | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩,冷却结晶 | 制备硫酸镁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 加热盛有NH4Cl固体的试管, | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| D | 向NaBr溶液中滴入少量氯水和苯,振荡、静置, | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe3+ | B. | HS- | C. | 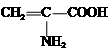 | D. | C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com