
分析 (1)溴化银的溶度积比氯化银小,从沉淀平衡移动的角度分析,根据溶度积常数计算;
(2)焦炭与水蒸气反应的化学方程式为:C(s)+H2O(g)═CO(g)+H2(g),该反应可由已知热效应的热化学方程式推导,根据盖斯定律计算该反应的焓变,H2(g)的燃烧热是指1molH2(g)完全燃烧生成H2O(l)时放出的热量.
解答 解:(1)AgCl比AgBr溶解度大,所以AgCl饱和溶液中c(Ag+)较大,若向AgBr的饱和溶液中加入少量AgCl的固体,则c(Ag+)增大,AgBr的沉淀溶解平衡逆移,所以c(Br-)将减小,
若取0.188g的AgBr(相对分子质量188)固体放入l00mL水中(忽略溶液体积的变化),则则溶液中Br-的物质的量的浓度为c(Br-)=$\sqrt{{K}_{sp}(AgBr)}$=$\sqrt{1.0×1{0}^{-12}}$=1.0×10-6mol/L,
故答案为:减小;1.0×10-6mol/L;
(2)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-24l.8kJ/mol,
②C(s)+$\frac{1}{2}$O2═CO(g)△H2=-110.5kJ/mol,
焦炭与水蒸气反应的化学方程式为:C(s)+H2O(g)═CO(g)+H2(g),该反应可由②-①得到,根据盖斯定律,该反应的焓变为△H=△H2-△H1=-110.5-(-241.8)=+131.3kJ/mol,则焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ/mol,
lg水蒸气转化成液态水放热2.5kJ,1g水蒸气的物质的量为$\frac{1g}{18g/mol}$=$\frac{1}{18}$mol,则1mol水蒸气转化为液态水放出的热量为45kJ,反应的热化学方程式为:③H2O(g)═H2O(l)△H3=-45kJ/mol,
H2(g)的燃烧热是指1molH2(g)完全燃烧生成H2O(l)时放出的热量,方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l),该反应可由①+③得到,根据盖斯定律,该反应的焓变为△H=△H1+△H3=-241.8-45=-286.8kJ/mol,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ/mol;-286.8.
点评 本题考查难溶电解质的溶解平衡,热化学方程式的书写,盖斯定律的应用,题目难度中等,注意燃烧热是指1mol物质完全燃烧,生成稳定的参考物质时放出的热量,H2(g)完全燃烧需变成H2O(l),不是H2O(g),这是易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生 能使品红褪色的气体.S2Cl2的结构与H2O2类似.下列说法不正确的是( )
S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生 能使品红褪色的气体.S2Cl2的结构与H2O2类似.下列说法不正确的是( )| A. | S2C12分子中的两个S原子均是sp3杂化 | |
| B. | S2C12 与 H20 反应的化学方程式是:2S2C12+2H2O═SO2↑+3S↓+4HC1 | |
| C. | S2Br2与 S2C12结构相似,熔、沸点:S2Br2>S2C12 | |
| D. | S2C12是含有极性键和非极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该硝酸的物质的量浓度为2.0mol/L | |
| B. | 第一次剩余的4.8g金属为铜 | |
| C. | 向反应后的溶液中再加入稀硝酸40mL,得到的NO在标准状况下的体积为0.56L | |
| D. | 向反应后的溶液中加入足量NaOH溶液,充分反应后,过滤,将滤渣洗涤、干燥、灼烧,得到固体质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
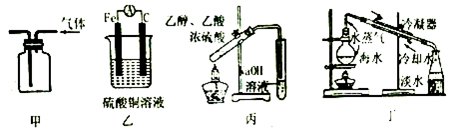
| A. | 装置甲:排空气法收集H2 | B. | 装置乙:组成原电池,产生电流 | ||
| C. | 装置丙:实验室制取乙酸乙醋 | D. | 装置丁:海水蒸馏得淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烷、异丁烷互为同系物 | |
| B. | 甲烷与氯气在紫外线照射下的反应产物有4种 | |
| C. | 应用分馏方法可将煤焦油中的苯等芳香族化合物分离出来 | |
| D. | 2-丁烯:CH3CH=CHCH3分子中的四个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C5H10O2,能与NaHCO3反应 | 4 |
| D | 分子式为C9H12的芳香族化合物 | 7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将乙烯通入溴的四氧化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| B | 向Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀硝酸,沉淀不溶解 | Na2SO3被空气氧化变质 |
| C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
| D | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com