
科目:高中化学 来源:2016届山东省高三5月模拟一理综化学试卷(解析版) 题型:填空题
草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
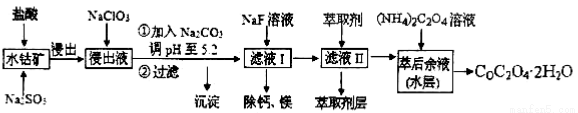
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为
____________________________________________________________________________
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液=______。
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
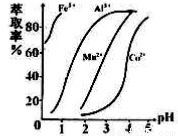
a.1 b.2 c.3 d.4
(6)已知:NH3·H2O NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4 H++HC2O4- Ka1=5.4×10-2;HC2O4-
H++HC2O4- Ka1=5.4×10-2;HC2O4- H++C2O42- Ka2=5.4×10-5;
H++C2O42- Ka2=5.4×10-5;
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
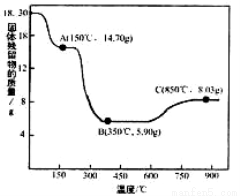
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是
A.Mg C
C SO3
SO3
B.0.1mol•L-1HCl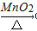 Cl2
Cl2 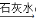 Ca(ClO)2(aq)
Ca(ClO)2(aq)
C.NaCl饱和溶液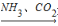 NaHCO3
NaHCO3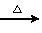 Na2CO3
Na2CO3
D.淀粉溶液 葡萄糖
葡萄糖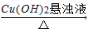 Cu2O
Cu2O
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:选择题
分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有
A.2种 B.4种 C.6种 D.8种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:填空题
有机物A为烃类化合物,相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3 ,且它们均含有4种等效H。

已知:1)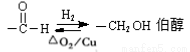 2)
2)
请回答:
(1)B中所含官能团的名称为__________;
(2)Ⅱ、Ⅲ的反应类型依次为为 __________(填字母序号);
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
a.反应Ⅰ:________________________________________
b.A 在催化剂条件下,反应生成高聚物:________________________________________
(4)A 的系统命名为____________________,A 的同分异构体中有一对互为顺反异构的链状有机物,且结构中含有2个—CH3,其顺式异构体的结构简式为__________
(5)C的某同分异构体F可以催化氧化,但不能发生消去反应,F的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是
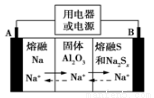
A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
用下列实验装置进行的实验中,能达到相应实验目的的是
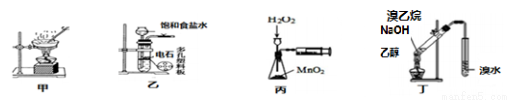
A.用图甲蒸干CuCl2饱和溶液制备CuCl2晶体 B.用图乙制取乙炔气体
C.丙装置可定量测定 H2O2的分解速率 D.丁可用于证明实验中生成了乙烯
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA
B.3molFe在足量的水蒸气中完全反应转移9NA个电子
C.2.0gH218O与D2O的混合物中所含中子数为NA
D.1molNa2CO3晶体中含离子总数大于3NA
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
下图为工业合成氨生产简易流程图:

回答下列问题:
(1)合成氨所需的氮气来源于__________;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如下表:
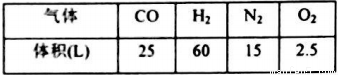
计算该富氧空气中O2和N2的体积比V(O2):V(N2)=__________。
(2)在合成氨的原料气中混有的杂质必须除去的原因是__________;
上述流程中热交换器的作用是__________。从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨。为提高原料的利用率,通常采取的措施是__________。
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快,②__________。
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):__________。
②氨基甲酸铵受热分解为尿素与水:__________。
(5)新法合成氨常采用电解法合成。即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率,新法合成氨所用的电解质能传导H+,则阴极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com