
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是__________________,分离得到固体的主要成分是________,从固体中分离出铜需采用的方法是___________________________________;
(3)过程Ⅱ中发生反应的化学方程式为________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为__________________________。(列式计算)
(1)2Fe3++Cu=2Fe2++Cu2+
(2)回收铜 铜和铁 加盐酸后过滤
(3)FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2??? 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)c(Fe3+)= =4.0×10-11 mol/L
=4.0×10-11 mol/L
【解析】(1)Fe3+具有强氧化性,能将Cu氧化成Cu2+。
(2)废液中含有Cu2+,过程Ⅰ中加入过量铁屑发生反应:Cu2++Fe=Fe2++Cu,分离出的固体是铜和铁。用盐酸溶解铁,可分离出铜。
(3)过程Ⅱ的滤液中含有FeCl2,加入石灰水后发生反应:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2,鼓入空气后可将Fe(OH)2氧化为Fe(OH)3。
(4)由Ksp[Fe(OH)3]及pH=5可知:c(Fe3+)·c3(OH-)=c(Fe3+)×(10-9)3=4.0×10-38,则c(Fe3+)= =4.0×10-11 mol/L。
=4.0×10-11 mol/L。


科目:高中化学 来源: 题型:
| 4.0×10-38 |
| (10-9)3 |
| 4.0×10-38 |
| (10-9)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
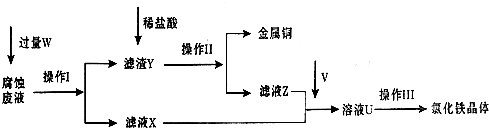
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高一上学期期末考试化学试卷(带解析) 题型:实验题
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南通市海安县高一上学期期末考试化学试卷(解析版) 题型:实验题
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com