
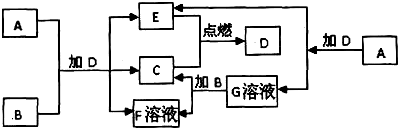
 ,
, ;
;| 81g |
| 27g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 改变条件 | 新平衡与原平衡比较 | |
| A | 升高温度 | X的转化率变小 |
| B | 增大压强 | X的浓度变小 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
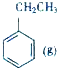 +CO2(g)?
+CO2(g)?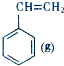 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
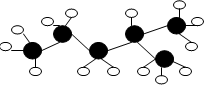 Ⅰ(1)如图是某烷烃球棍模型,其中的白球表示氢原子,短棍表示共价键,黑球表示C原子,则该烃名称是
Ⅰ(1)如图是某烷烃球棍模型,其中的白球表示氢原子,短棍表示共价键,黑球表示C原子,则该烃名称是 ,此烷烃的一溴代物有
,此烷烃的一溴代物有查看答案和解析>>
科目:高中化学 来源: 题型:
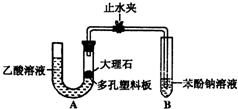 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. -ONa溶液的pH,其pH由大到小排列的顺序为
-ONa溶液的pH,其pH由大到小排列的顺序为查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离平衡常数(25℃) |
| NH3?H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
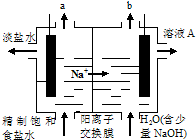
| A、溶液A的溶质是NaOH |
| B、阴极附近溶液pH升高 |
| C、气体a为氯气,其电极反应为2Cl--2e-═Cl2↑ |
| D、与产生气体b的电极相连的是电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
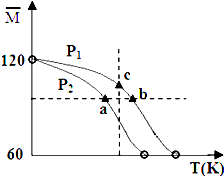 已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(
已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(. |
| M |
| m总 |
| n总 |
| A、该过程的△H<0 |
| B、气体压强:P(a)<P(b)=P(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件下进行,以提高乙酸纯度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com