
【题目】下列物质中的硫元素不能表现氧化性的是( )
A.H2SB.SC.H2SO3D.H2SO4
科目:高中化学 来源: 题型:
【题目】等体积的硫酸钾、硫酸铜、硫酸铝溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
A. 1:2:3 B. 1:6:9 C. 1:2:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①Al2(SO4)3②Na2CO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是
A. ①③④⑤ B. ②④ C. ①②③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温迫使植物细胞产生大量对细胞有害的过氧化物,如脂质过氧化物(MDA)。超氧化物歧化酶(SOD)能够消除过氧化物,从而增强植物的抗冷性。研究人员进行了“水杨酸对水稻幼苗抗冷性的影响”实验,实验步骤及结果如表所示。
组别 | 处理 | 培养温度 /℃ |
|
1 | 蒸馏水浇灌 | 25 | 7.3 |
2 | ① | ② | 9.4 |
3 | 0.5 mmol/L水杨酸浇灌 | 5 | 10.3 |
4 | 1.0 mmol/L水杨酸浇灌 | 5 | 11.6 |
5 | 1.5 mmol/L水杨酸浇灌 | 5 | 13.6 |
6 | 2.0 mmol/L水杨酸浇灌 | 5 | 8.5 |
7 | 2.5 mmol/L水杨酸浇灌 | 5 | 7.9 |
8 | 3.0 mmol/L水杨酸浇灌 | 5 | 6.5 |
(1)表中①是 ,②是 ,其的作用为 ,实验设计时每组取50株水稻幼苗,而不是1株,目的是 。
(2)本实验自变量为 , ,需要控制的无关变量有 , (至少写两个)。
(3)组别1和2对照可得的结论是 。对比组别2~8可得的结论是 。
(4)在5 ℃的环境下,物质的量浓度为2.0 mmol/L的水杨酸对水稻幼苗抗冷性的影响是 (填“增强”或“减弱”)。
(5)请根据5 ℃条件下的实验结果完成水杨酸浓度—SOD活性关系的坐标曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氧化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是__________________,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离了方程式表示)___________________________。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol/L,c(Fe3+)=1.0×10-3mol/L,c(Cl-)=5.3×10-2mol/L,则该溶液的pH约为________________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□___=□Cl-+□Fe3++□____。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号)___________。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______________________。
(4)天津某污水处理厂用氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_________mg·L-1。
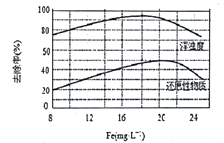
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从学生实验中老师发现,同学们在进行实验时,出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作。如图所示实验操作中正确的是
A. 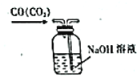 B.
B.  C.
C. 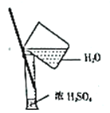 D.
D. 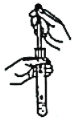
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3 的制备分两步进行,反应方程式如下:
ⅰ.2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2
ⅱ.NaNH2+N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装 置模拟工业级NaN3的制备。
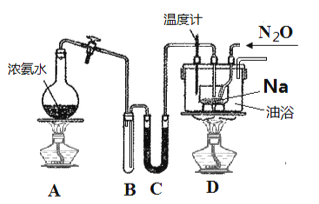
回答下列问题:
实验Ⅰ:制备
(1)装置C中盛放的药品为____________________,装置D中进行油浴而不用水浴的主要原因是_______________________。
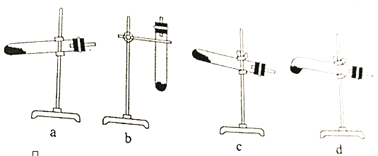
(2)N2O可由NH4NO3在240~245℃ 分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__________________(图中加热装置已略去),该反应的化学方程式为______________,在制备NaN3的实验过程中,当观察到_______________时开始通入N2O。
实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。
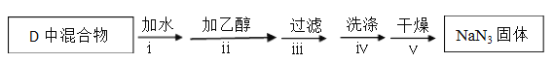
已知:NaNH2能与水反应生成NaOH 和氨气
(3)操作Ⅳ采用乙醚洗涤的原因是________________________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6 溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲哕啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
(4)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有_____________。
(5)试样中NaN3的质量分数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com