
【题目】取两份铝片,第一份与足量稀硫酸反应,第二份与足量NaOH溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为 ( )
A.2:3B.1:1C.3:2D.1:3
科目:高中化学 来源: 题型:
【题目】关于基本营养物质的说法正确的是( )。
A.所有蛋白质均可通过颜色反应来鉴别
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1,已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1,已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。

(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,求该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的离子组是( )
A.K+、Cu2+、NO3-、SO42-- B.K+、Na+、Cl-、SiO32-
C.Al3+、NH4+、NO3-、Cl- D.K+、Na+、AlO2-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑦七种元素在周期表中的位置。

请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)_________。
(2)③与⑦的气态氢化物中,稳定性较强的是(填化学式)_________。
(3)元素⑥的最高价氧化物对应的水化物是(填化学式)_________。
(4)由①、②、③三种元素组成的离子化合物是_________,检验该化合物中阳离子的方法是_________。
(5)含有上述元素的物质间存在以下转化。
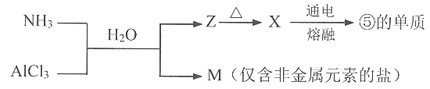
M所含的化学键类型是_________。X生成⑤的单质的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
物质 | 熔点/℃ | 性质 |
H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。

(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
③已知50℃时c(MnO![]() )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO![]() )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然物质水解叙述不正确的是( )
A. 油脂水解可以得到丙三醇 B. 可用碘水检验淀粉是否水解完全
C. 天然蛋白质水解的最终产物为小肽 D. 纤维素水解和淀粉水解得到的最终产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示。下列说法正确的是

A. X难溶于乙醇
B. 酒中的少量丁酸能抑制X的水解
C. X的分子式为C6H10O2
D. 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体异构)
【答案】B
【解析】X是醇,易溶于酒精,故A错误;X水解产物是丁酸,所以丁酸能抑制X的水解,故B正确;X的分子式为C6H12O2,故C错误;分子式为C4H8O2且官能团与X相同的物质有HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3共4种,故D错误。
【题型】单选题
【结束】
5
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是
A. 原子半径的大小为:Z>Y>X>W
B. 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
C. 元素的非金属性:Y>Z
D. 若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)(1)已知在448℃时,反应H2(g)+I2(g)2HI(g)ΔH<0的平衡常数K1为49,则该温度下反应2HI(g)H2(g)+I2(g)的平衡常数K2为______;反应1/2H2(g)+1/2I2(g)HI(g)的平衡常数K3为_______.
(2)在某一密闭容器中发生上述反应,改变反应的某一条件(混合气体的总物质的量不变),造成容器内压强增大,则下列说法中正确的是_____
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.I2(g)的转化率增大,H2的平衡浓度变小
D.改变条件前后,速率图象如图所示
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______.
(2)该反应为______反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是______.
A.容器中压强不变 B.混合气体中c(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),判断此时温度为______℃.
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L (H2)=1.5mol/L 、 c(CO)=1mol/L 、 c(H2O)=3mol/L,则下一时刻,反应向_________填“正反应”或“逆反应”)方向进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com