
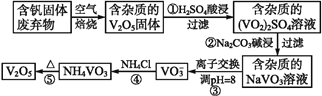
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
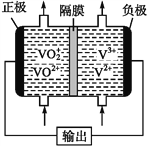
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
【答案】 VO2+、 Al3+ Al(OH)3 NH4++VO3- ![]() NH4VO3↓( 10Al(s)+3V2O5(s)
NH4VO3↓( 10Al(s)+3V2O5(s)![]() 5Al2O3(s)+6V(s)ΔH=—
5Al2O3(s)+6V(s)ΔH=—![]() kJ·mol-1 V2+-e-
kJ·mol-1 V2+-e-![]() V3+ VO2+-e-+H2O
V3+ VO2+-e-+H2O![]() VO2++2H+
VO2++2H+
【解析】流程分析:含钒固体废弃物(含有SiO2、Al2O3及其他残渣),要提取钒,则要除去Si、Al等残渣。步骤①培烧后,用硫酸溶解,生成(VO2)2SO4和Al2(SO4)3,SiO2等不溶性杂质过滤可除去;步骤②是用碳酸钠溶液与(VO2)2SO4和Al2(SO4)3反应,与(VO2)2SO4反应生成NaVO3,碳酸根离子与铝离子水解相互促进生成Al(OH)3沉淀;步骤④是NaVO3溶液与氯化铵反应生成NH4VO3沉淀;步骤⑤加热NH4VO3分解为V2O5。
(1)用硫酸溶解,生成(VO2)2SO4和Al2(SO4)3,溶液中的阳离子除氢离子外还有VO2+、 Al3+。
故答案为:VO2+、Al3+;
(2)用碳酸钠溶液碱浸含杂质的(VO2)2SO4溶液,生成含杂质的NaVO3溶液,碳酸根离子与Al3+水解相互促进生成Al(OH)3沉淀,所以反应②碱浸后滤出的固体主要成分是Al(OH)3。
故答案为:Al(OH)3;
(3)步骤④是NaVO3溶液与氯化铵反应生成NH4VO3沉淀,离子方程式为NH4++VO3-=NH4VO3↓;
(4)已知①4Al(s)+3O2(g)═2Al2O3(s)△H1=a kJ/mol
②4V(s)+5O2(g)═2V2O5(s)△H2=b kJ/mol
据盖斯定律,(①×5②×3)÷2得:10Al(s)+3V2O5(s)= 5Al2O3(s)+6V(s) △H=![]() kJ/mol;
kJ/mol;
(5)钒液流电池放电时负极,失电子,化合价升高,发生氧化反应,应为V2+→V3+,故电极反应式为V2+-e-=V3+;充电时,原正极变阳极,阳极失电子,化合价升高,发生氧化反应,应为:VO2+→VO2+,电极反应式为VO2+-e-+H2O=VO2++2H+。
故答案为:V2+-e-=V3+ ;VO2+-e-+H2O=VO2++2H+。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.采用原煤脱硫技术,可减少燃煤燃烧时产生的SO2
B.自来水可用氯气来杀菌消毒,说明氯气无毒
C.氮氧化物可以破坏臭氧层,也能形成酸雨
D.化石燃料燃烧产生大量CO2,会导致温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示。则下列叙述中正确的是
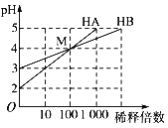
A. 稀释前,c(HA)=10c(HB)
B. 在M点两种溶液中水的电离程度相同
C. pH=a的0.1 mol·L-1HB溶液与pH=b0.01 mol·L-1HB溶液相比,a+1<b
D. 加水稀释HB溶液,HB的电离度增大,c(H+)/c(HB)减小,溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
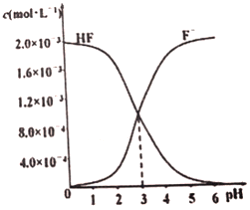
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。
(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.钾的金属性比钠强
B.溴的非金属性比氯强
C.ⅦA族中原子半径最小的是氟
D.第三周期中,除稀有气体元素外原子半径最大的是钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=﹣lg c[OH﹣])与pH的变化关系如图所示,则( ) 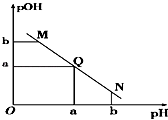
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO﹣)>c(Na+)
C.M点和N点所示溶液中水的电离程度不相同
D.Q点消耗NaOH溶液的体积小于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1 mol N2和1 mol CO2进行比较,下列说法不正确的是
A.分子数一定相同 B.原子数一定不相同
C.体积一定相同 D.质量一定不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com