
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
分析 A、MgF2晶体中只含离子键;
B、金属在熔融态能导电;
C、N2分子中是氮氮叁键,而Cl2分子中氯氯单键,所以每个原子的最外层都具有8电子稳定结构;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成.
解答 解:A、MgF2晶体中的化学键是离子键,而不是共价键,故A错误;
B、金属在熔融态能导电,不含离子键,故B错误;
C、N2分子中是氮氮叁键,而Cl2分子中氯氯单键,所以每个原子的最外层都具有8电子稳定结构,故C正确;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成,所以不仅是克服分子间作用力,故D错误;
故选C.
点评 本题考查化学键的类型、物质的导电性、8电子稳定结构等,难度不大,注意化学反应的实质是化学的断裂与形成的过程.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 氧化钠与水反应生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 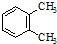 与 与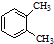 是同分异构体 是同分异构体 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
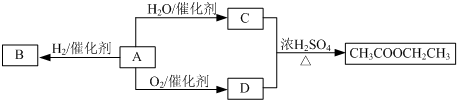
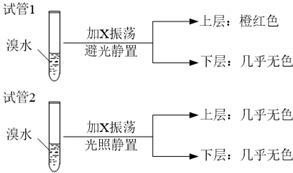
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应的水化物碱性强弱:COH<D(OH)2 | |
| B. | 元素D、E可形成化合物,两元素的单质可通过电解该化合物的水溶液得到 | |
| C. | 化合物BA4和BAE3的空间结构均为正四面体 | |
| D. | 从化合价角度分析,有人认为元素A在周期表中的位置可以放在IA族、IVA族、VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
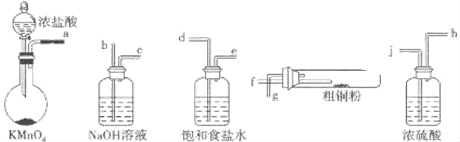
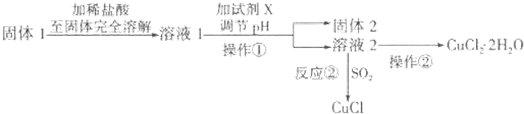
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
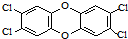 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com