
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.滴入石蕊试液显蓝色的溶液中:K+、Na-、HSO3-、ClO-
B.0.1mol?L-l的Fe(NO3)2溶液中:Na+、H+、SCN-、I-
C.0.1mol?L-l的NaAlO2溶液中:K+、H+、NO3-、SO42-
D.由水电离产生的c(H+)=1×10-13mol?L-l的溶液中:Na+、Ba2+、NO3-、Cl-
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:选择题
工业上消除氮氧化物的污染,可用如下反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:

下列说法不正确的是
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a < 0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图。下列有关说法正确的是
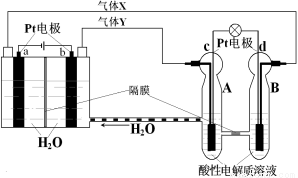
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法正确的是
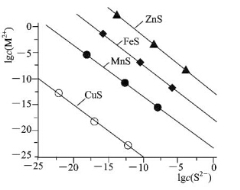
A.Ksp(CuS)约为l×10-20
B.向Cu2+浓度为10-5mol?L-1废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol?L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol?L-1 Na2S溶液,Zn2+先沉淀
D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:填空题
(14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
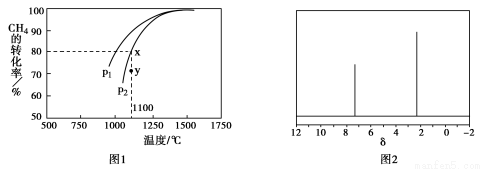
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是
A.向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3
B.向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性
C.将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊
D.向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:推断题
(15分)紫杉醇(paclitaxel)是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如下:
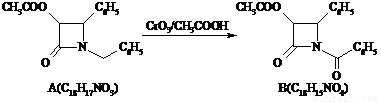

(1)A的合成应用了2010年诺贝尔化学奖的获奖成果——交叉偶联反应,反应式如下(已配平):
CH3COOCH2COCl + X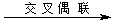 A + HCl
A + HCl
X分子中含碳氮双键(C=N),其结构简式为 。
(2)已知酯和酰胺在过量醇中能发生醇解反应:
CH3COOC2H5+CH3OH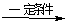 CH3COOCH3+C2H5OH
CH3COOCH3+C2H5OH
CH3CO +CH3OH
+CH3OH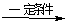 CH3COOCH3+H
CH3COOCH3+H
“醇解反应”的反应类型为 ,B转化为C中另一产物的结构简式为 。
(3)若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F。
①E在一定条件下能发生缩聚反应,写出所得高分子化合物的一种可能的结构简式: ;
②F的同分异构体中,属于芳香族化合物、能发生银镜反应且核磁共振氢谱有4个峰的有两种,请写出其中一种的结构简式: 。
(4)已知:①RCHO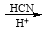
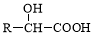 ②R′COOH
②R′COOH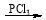 R′COCl
R′COCl
写出以甲醛和乙醛为原料合成CH3COOCH2COCl的路线流程图(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:实验题
(17分)中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4?7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
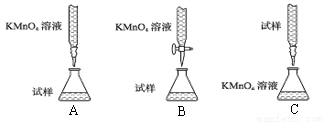
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管、量筒外,还需要 (填仪器名称)。
③该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10mol?L-1FeSO4、0.02mol?L-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。
实验序号 | V[0.10mol?L-1FeSO4] /mL | KMnO4溶液褪色所需时间t/s | ||
1 | a | t1 | ||
2 | a | t2 |
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如右图所示。

①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)= 。
②b点处溶液中c (Cl-) c (NH4+)(填“>”、“<”或“=”)。
③取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释: 。
④d点所示溶液中离子浓度由大到小的排序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com