
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后,溶液中NH4+、Fe2+、SO42-的物质的量减少,而Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有二种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
科目:高中化学 来源:2016届江西省高三5月模拟考试理综化学试卷(解析版) 题型:实验题
某学习小组研究溶液中Fe2+的稳定性;进行如下实验,观察,记录结果。
实验I
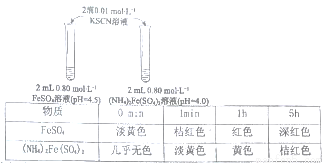
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验I中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+有还原性,进行实验Ⅱ,否定了该观点,补全该实验。

(3)乙同学提出实验I中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ;分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O 4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
(4)进一步研究在水溶液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率逐渐增大的原因可能是_________。
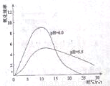
(5)综合以上实验,增强Fe2+稳定性的措施有_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
甲醛(H2C=O)在Ni催化作用下加氢可得到甲醇(CH3OH),以下说法中正确的是
A.甲醇、甲醛分子间都可以形成氢键
B.甲醇分子内C原子采取sp2杂化,O原子采取sp杂化
C.甲醛为极性分子,分子中两个C—H键夹角小于120°
D.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:选择题
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl 。
下列说法不正确的是( )
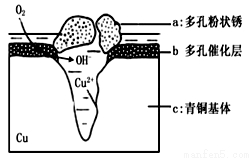
A. 腐蚀过程中,负极 a被氧化
B. 环境中的Cl-扩散到孔口,并与正极反应产物和负极
反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C. 若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D. 正极的电极反应式为: 正极反应是 O2+ 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:填空题
(化学—选修3:物质结构与性质)
氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化: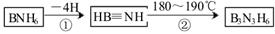
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子韵杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。
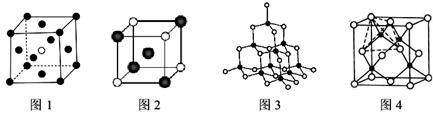
(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因____________________。
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法。若图4晶胞的棱长为a nm,密度为ρ g·cm-3,则阿伏加德罗常数为__________(要求化为最简关系)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
用相对分子质量为43的烷基取代烷烃(C4H10)分子中的一个氢原子,所得的有机物有(不考虑立体异构)( )
A.5种 B.7种 C.8种 D.4种
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:实验题
NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
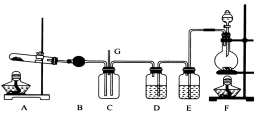
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
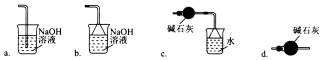
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、G、M的原子序数依次增大,X、Z同主族,可形成离子化合物ZX,Y单质是空气的主要成分之一,可形成MY2、MY3两种分子,G为金属元素。下列判断错误的是
A.原子半径:Z>G>M>Y
B.G与Y形成的化合物一定既能与盐酸反应,又能与烧碱溶液反应
C.X、Z分别与Y可形成原子数为1:1的物质
D.X、M形成的简单阴离子的还原性:X > M
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5mol•L﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH﹣)+c(HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com