
| A. | 44g CO2含有氧原子数为NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 23gNa在足量的O2中充分燃烧失去2mole-生成Na2O2 | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
分析 A.质量转化为物质的量,结合1个二氧化碳分子含有2个氧原子解答;
B.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子;
C.钠失去电子生成+1价钠离子;
D.依据方程式:2Na2O2+2CO2=2Na2CO3+O2,消耗2mol二氧化碳,转移2mol电子.
解答 解:A.44g CO2含有氧原子数为44$\frac{44g}{44g/mol}$×2×NA=2NA,故A错误;
B.过氧化钠中氧元素为-1价,则过氧化钠与水反应时,生成0.1mol氧气转移0.2mol电子,转移的电子数为0.2NA,故B正确;
C.23gNa物质的量为$\frac{23g}{23g/mol}$=1mol,在足量的O2中充分燃烧失去1mole-生成Na2O2,故C错误;
D.标准状况下,5.6LCO2物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,依据方程式:2Na2O2+2CO2=2Na2CO3+O2,消耗2mol二氧化碳,转移2mol电子,所以转移电子数为:0.25 NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的综合应用,熟练地运用与物质的量相关的计算公式,明确物质的结构是解题关键,注意氧化还原反应中电子转移数目的计算,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
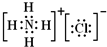 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①②④ | C. | ①④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为:MnO2(s)+2H2O(1)+2e-═Mn(OH)2 (s)+2OH-(aq) | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com