
���н�����ʵ�Ļ�ѧ����ʽ�����ӷ���ʽ����ȷ���ǣ� ��
A�����ҽ���Һ�м������ᡢ˫��ˮ��2I-+2H++H2O2=I2+2H2O
B����Ȼ�����ԭ��ͭ�����ᆳ�������������ú����������ͭ����������Һ��PbS������ת��Ϊͭ����CuS����Cu2++SO42-+PbS�TCuS+PbSO4
C����ȼúʱ��������ʯ��ʯ���ɼ���SO2���ŷţ�2CaCO3+O2+2SO2�T2CaSO3+2CO2
D�����μ�أ����϶�NaCl��Na2CO3����ͨ��ʩ������CaSO4���ɽ��������ļ��ԣ�
CaSO4+Na2CO3�TCaCO3��+Na2SO4
 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ�ϵ�һ�ζο���ѧ���������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A��64 g SO2 ������ԭ����ΪNA
B�����ʵ���Ũ��Ϊ0.5 mol��L��1��MgCl2��Һ������Cl�� ��ΪNA
C����״���£�22.4 L H2O�ķ�����ΪNA
D�����³�ѹ�£�14 g N2���з�����λ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ�Ͻβ�һ��ѧ���������棩 ���ͣ�ѡ����
���ij��Һ�н�����K+��Cu2+��SO42����Cl���������ӣ�����K+��Cu2+��Cl���������ӵĸ�����Ϊ4��5��8����K+��SO42�������ʵ���Ũ��֮��Ϊ�� ��
A��2��3 B��4��1 C��4��3 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�����ϵڶ���������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ø�������(Na2FeO4)�Ժӡ���ˮ�����dz�������ˮ�������¼�������֪��Ӧ��Fe2O3+ 3Na2O2= 2Na2FeO4+Na2O������˵����ȷ���ǣ� ��
A��Na2O2�������������ǻ�ԭ��
B��Fe2O3�ڷ�Ӧ����������
C��1molNa2O2������Ӧ����4mol����ת��
D����Na2FeO4������ɱ�����������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڵڶ����¿���ѧ���������棩 ���ͣ�������
��п��ͭ���ɵĺϽ�10 g������������ϡ�����г�ַ�Ӧ��������״��������2��24L������Ͻ���ͭ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڵڶ����¿���ѧ���������棩 ���ͣ�ѡ����
����ȼ�ϵ����һ�ָ�Ч�������ķ���װ�ã������Բ����缫��KOH��Һ�����Һ���ܷ�ӦΪ��2H2 + O2 = 2H2O��������ӦΪ��O2 + 2H2O + 4e- = 4OH- �� ������������ȷ����
A��H2ͨ�븺����
B��O2ͨ��������
C��������ӦΪ2H2 + 4OH- ��4e- = 4H2O
D����������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڵڶ����¿���ѧ���������棩 ���ͣ�ѡ����
����˵����ȷ����( )
A.�к���һ����ǿ ���ǿ�Ӧ�ų�������
���ǿ�Ӧ�ų�������
B.1 mol����1 mol ����ȫ��Ӧ�ų����������к���
C.��ϡ��Һ��,�������кͷ�Ӧ����1 mol H2O(l)ʱ�ķ�Ӧ�Ƚ����к���
D.�ⶨ�к���ʱ����ϡ�����ϡBa(OH)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������и߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
�ơ��صĵ⻯���������Ϳ�ѧʵ������ʮ����Ҫ��Ӧ�á���ҵ���õ⡢NaOH����мΪԭ�Ͽ������⻯�ƣ��������������£�
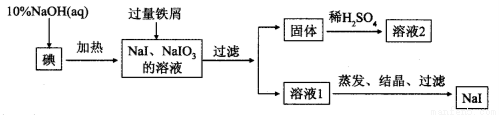
(1)�������ڱ��е�λ��Ϊ_________________.
(2)NaOH��Һ�͵ⷴӦʱ��Ҫ�ϸ�����¶ȣ�����¶ȹ��ͣ������ɵ�ĵͼ۸���ƷNaIO����NaOH��Һ�͵ⷴӦʱ������Һ��IO3-��IO-�������ʵ���֮��Ϊ1 ��1������ɸ÷�Ӧ�����ӷ���ʽ����ƽ
______I2+______OH-=______IO3- +__IO- +______I- +______H2O
(3)���������м��������м��Ŀ����______________���������ù����г�ʣ����м�⣬���к��ɫ���壬�������мʱ������Ӧ�Ļ�ѧ����ʽ��___________________��
(4)��Һ2�г�����H���⣬һ�����е���������_______________��
(5)��֪I-�ױ������е�O2�����������Һ1�л��NaI����IJ���������__________��_________�����ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵķ��뷽���У���������С��ȷ�����뷽������( )
A����ȡ B���ᾧ C������ D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com