
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
分析 A、乙烯是一种植物激素,可用作水果和蔬菜的催熟剂;
B、地沟油中含有大量的有害物质,在碱性条件下水解可以用来制肥皂;
C、漂白粉在空气中变质是因为其有效成分CaClO2会与空气中的CO2、H2O反应生成HClO,HClO分解使漂白粉变质失效;
D、丙烷只有一种结构.
解答 解:A、乙烯是一种植物激素,可用作水果和蔬菜的催熟剂,故A正确;
B、地沟油中含有大量的有害物质,“地沟油”禁止食用,但可以用来制肥皂,故B正确;
C、漂白粉长期暴露在空气中,其有效成分Ca(ClO)2会与空气中的CO2、H2O反应生成HClO,HClO分解使漂白粉变质失效,故C正确;
D、丙烷只有一种结构,不存在同分异构体,故D错误,
故选D.
点评 本题考查常见有机物的性质,涉及乙烯、油脂、漂白粉的性质以及同分异构体等,题目难度不大,注意化学与生产生活的联系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中加少量的CH3COONa固体,平衡正向移动 | |
| B. | 0.10 mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
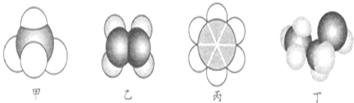
| A. | 22.4 L甲中含有10 mol电子 | |
| B. | 乙与乙的加聚产物都能使溴水褪色 | |
| C. | 丙不能与溴水、酸性高锰酸钾溶液发生反应 | |
| D. | 丙、丁都可以萃取溴水中的溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 用图丙所示仪器配制0.150mol/LNaOH溶液 | |
| D. | 如图丁所示可用于实验室制氨气并收集干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性KI淀粉溶液在空气中久置后变蓝:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 铅蓄电池充电时阴极质量减轻:PbSO4+2e-=Pb+SO42- | |
| D. | 明矾与足量Ba(OH)2溶液混合有沉淀出现:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

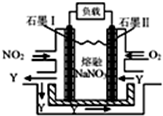
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com