
| A. | 由质子和电子构成 | B. | 由原子核和核外电子构成 | ||
| C. | 由质子和中子构成 | D. | 由中子和电子构成 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | H2 和 D2 互为同位素 | |
| B. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| C. | 甲苯和 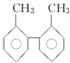 互为同系物 互为同系物 | |
| D. | 金刚石、石墨和“足球烯”(分子式为 C60)为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
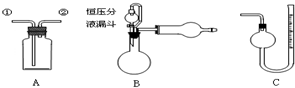
| A. | 装置A从①进气,用排水法可收集NO气体 | |
| B. | 装置A中盛饱和Na2CO3溶液,从①进气除去CO2中混有的HCl | |
| C. | 装置A、B组合,从A中①进气可制备、收集干燥纯净的NH3 | |
| D. | 装置B、C组合,可测定一定质量样品中Zn的氧化程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
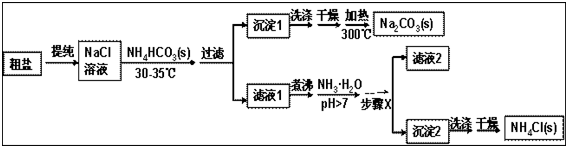
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com