
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是
A. “石碱”中含有离子键 B. “石碱”中含有极性共价键
C. “石碱”是离子化合物 D. “石碱”中含有非极性共价键
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】如图所示为800 oC时A、B、C三种气体在密闭容器中反应时浓度的变化,分析图像得出的结论错误的是( )
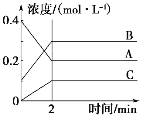
A. A是反应物
B. 前2 min A的反应速率为0.1 mol·L-1·min-1
C. 2min后反应达到平衡,v(A)正 = v(C)逆
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲萘醌(维生素K)有止血作用,它可通过2—甲基萘的氧化而制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
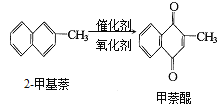
在某次合成反应中,用1.4g的2—甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是
A.使用了过量的氧化剂 B.没有用乙酸,而是使用了其它催化剂
C.把反应混合物加热 D.所生成的甲萘醌是沉淀物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氘(2H)用于热核反应,聚变时放出大量的能量,被称为“未来的天然燃料”。下列有关氘说法正确的是
A. 氘原子核内没有中子 B. 氘原子核外有2个电子
C. 氘与氚(3H)互为同位素 D. 氘与氚(3H)互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )

A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.100mol的四氧化二氮气体充入1L 抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为_______________________________________;达到平衡时四氧化二氮的转化率为_____% ;表中 c2_____c3____a____b(选填“ > ”、“ < ”、“ = ”)。
(2)20s时四氧化二氮的浓度 c1=________mol·L-1,在0s~20s内四氧化二氮的平均反应速率为_______mol·(L·s)-1;
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应A(g)+B(g)![]() 2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
(1)同温同压下,2molA与2molB反应达平衡时生成_______molC。
(2)恒温恒容下,2molA与2molB反应达平衡时生成_______molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com