
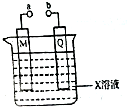
| A. | 若X、M、Q分别是H2SO4、Pb和PbO2,a、b连接后两极都有PbSO4生成 | |
| B. | 若X、M、Q分别是滴加酚酞的Na2SO4、C和Fe,a、b分别连接电源的正、负极,则通电后Q周围溶液颜色变红 | |
| C. | 若X、M、Q分别CuSO4、Cu和Fe,a、b分别连接电源的正、,则可在铁上镀铜 | |
| D. | 若X、M、Q分别是NaCl、C和Fe,则a、b连接后,M电极上有气体产生 |
分析 A.若X、M、Q分别是H2SO4、Pb和PbO2,为铅蓄电池;
B.若X、M、Q分别是滴加酚酞的Na2SO4、C和Fe,a、b分别连接电源的正、负极,为电解装置,Q为阴极生成氢气;
C.若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,为电镀装置,铜为阳极;
D.若X、M、Q分别是NaCl、C和Fe,则a、b连接后,铁发生吸氧腐蚀.
解答 解:A.若X、M、Q分别是H2SO4、Pb和PbO2,为铅蓄电池,铅蓄电池放电时,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,负极上铅失电子发生氧化反应,电极反应式为 Pb(s)+SO42-(aq)-2e-=PbSO4(s),都生成PbSO4,故A正确;
B.若X、M、Q分别是滴加酚酞的Na2SO4、C和Fe,a、b分别连接电源的正、负极,为电解装置,Q为阴极生成氢气,促进水的电离,Q极呈碱性,则Q周围溶液颜色变红,故B正确;
C.若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,为电镀装置,铜为阳极,可在铁上镀铜,故C正确;
D.若X、M、Q分别是NaCl、C和Fe,则a、b连接后,铁发生吸氧腐蚀,没有气体生成,故D错误.
故选D.
点评 本题考查较为综合,涉及原电池、电解池的综合考查,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原电池、电解池的工作原理以及电极方程式的书写,难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
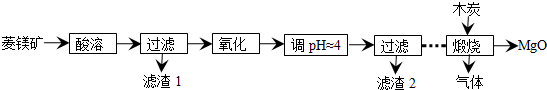
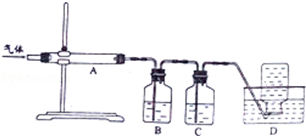
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
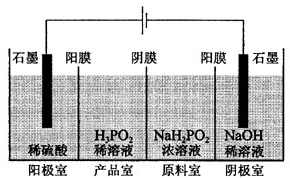 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一个反应,在一个温度下,有一个K值 | |
| B. | K越大,表示正向反应的倾向大,反应完全 | |
| C. | K值只能说明反应的最大限度,不能说明反应的速度 | |
| D. | 吸热反应的K值大于所有放热反应的K值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| B. | 标准状况下,2.24L氖气所含原子数为0.2NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数2 NA | |
| D. | 5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可大大提高生产效率 | |
| B. | 由反应需在300℃进行,可知该反应是吸热反应 | |
| C. | 增大原料气中CO2的百分含量,可以提高H2的转化率 | |
| D. | 70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)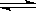 Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
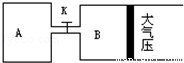
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | HClO | HNO3 |
| 弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com