
【题目】(15分)实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空: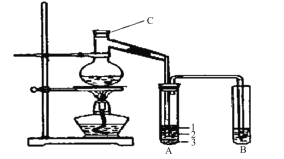
(1)装置图中C仪器的名称为 ,向C中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。如图所示试管A中的物质分为三层,产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈橙红色,除去其中杂质的最合理的方法是 (选填编号)。
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称应该是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
【答案】(1)蒸馏烧瓶(1分) 乙醇(1分) b(1分) (2)NaBr+H2SO4→HBr+NaHSO4、
HBr+CH3CH2OH![]() CH3CH2Br+H2O(共2分)(3)冷却收集溴乙烷、液封溴(2分) 3(1分)
CH3CH2Br+H2O(共2分)(3)冷却收集溴乙烷、液封溴(2分) 3(1分)
(4)HBr (1分) CH3CH2OH(1分) (5)d (2分) 乙烯(1分)
(6)浓硫酸氧化溴化氢会产生Br2,对橡胶腐蚀(2分)
【解析】
试题分析:(1)盛放反应物的仪器名称是圆底烧瓶;实验室制取少量溴乙烷利用硫酸、溴化钠、和乙醇发生取代反应制备,故其中加入的反应物是溴化钠、乙醇和1∶1的硫酸;配制体积比1∶1的硫酸所用的定量仪器为需用到b量筒;
(2)加热时烧瓶中发生的主要反应的化学方程式NaBr+H2SO4→HBr+NaHSO4,CH3CH2OH+HBr![]() CH3CH2Br+H2O;
CH3CH2Br+H2O;
(3)将生成物导入盛有冰水混合物的试管A中,溴乙烷的密度大于水,故冰水混合物的作用是冷却、液封溴乙烷;试管A中的物质分为三层(如图所示),产物在第3层;
(4)试管A中除了产物和水之外,还可能存在挥发出来的HBr、CH3CH2OH;
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,原因是浓硫酸强氧化性将溴化氢氧化为单质溴,单质溴溶于溴乙烷中而使有机物呈棕黄色,溴乙烷碱性条件下能水解,故除去其中杂质的正确方法是d用亚硫酸钠溶液洗涤;若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是乙烯;(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是反应会产生Br2,腐蚀橡胶。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】苯与乙烯相比较,下列叙述不正确的是
A. 都能在空气中燃烧
B. 都容易发生取代反应
C. 苯和乙烯都能在一定条件下发生加成反应
D. 苯不能使酸性KMnO4溶液褪色而乙烯能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:下列说法不正确的是


A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH—- 2e—=CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 某校学生用化学知识解决生活中的问题,下列家庭小实验中不合理的是( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
② 粗硅与干燥的HCl气体反应制得SiCl3(Si+ 3HCl![]() SiCl3 + H2)
SiCl3 + H2)
③ SiHC13与过量的H2在1100~1200℃的温度下反应制得纯硅,已知SiHCi3。能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为_________。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃ )中含有少量SiC14 (沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHC13采用的方法为________。
(3)实验室用SiHCl3 与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):

①装置B中的试剂是___________,装置C中的烧杯需要加热,目的是___________。
②反应一段时间后,装置D中观察到的现象是___________,装置D不能采用普通玻璃管的原因是___________,装置D中发生反应的化学方程式是___________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:

(1)四种元素原子半径由大到小的顺序是(写元素符号)_________________________。
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式________(用元素符号表示)。
(3)T元素的简单阴离子的结构示意图是______________________,
(4)证明该粒子的还原性比Z-强的离子方程式是____________________.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为_______________________ 。
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
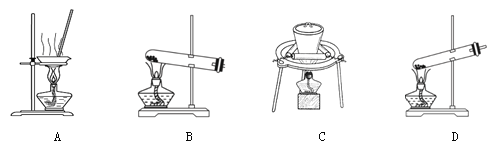
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.聚乙烯是无毒高分子化合物,可用作食品包装
B.在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因
C.推广使用新能源,可以减少二氧化碳等温室气体的排放
D.人造纤维、合成纤维和光导纤维都是有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com