
【题目】尿素[CO(NH2)2]是可由无机化合物合成的有机化合物,通常用作植物的氮肥。
(1)合成尿素的主要反应如下:
i.2NH3(g)+CO2(g)![]()
![]() (l)(氨基甲酸铵)△H=-159.5kJ·mol-1
(l)(氨基甲酸铵)△H=-159.5kJ·mol-1
ii. ![]() (l)
(l)![]()
 (l)+H2O(g)△H=+116.5kJ·mol-1
(l)+H2O(g)△H=+116.5kJ·mol-1
①CO2和NH3合成尿素的热化学方程式是____。
②工业上提高氨碳比[![]() (原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(2)某科研小组模拟工业合成尿素,一定条件下,在0.5 L的密闭容器中充入4 mol NH3和1molCO2,测得反应中各组分的物质的量随时间变化如图所示。.
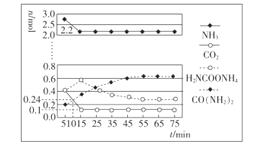
①反应进行到10 min时,用CO2表示反应i的速率v(CO2)=___。
②已知总反应的快慢由慢的一步反应决定,则合成尿素总反应进行到___min时达到平衡。
③合成尿素总反应的平衡常数为____。
(3)我国研制出金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。

①电极B为___(填“阴”或“阳”)极。
②A电极的电极反应式为____________。
【答案】2NH3(g)+CO2(g)![]()
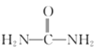 (l)+H2O(g)△H=-43kJ·mol-1 有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率
(l)+H2O(g)△H=-43kJ·mol-1 有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率 ![]() 55
55 ![]() 阴 CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+
阴 CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+
【解析】
(1)根据盖斯定律及平衡移动原理分析解答;(2)根据速率表达式及平衡常数表达式计算;(3)根据电解质原理分析解答。
(1)①由盖斯定律,CO2和NH2合成尿素的热化学方程式由反应ⅰ+反应ⅱ,可得:2NH3(g)+CO2(g)![]()
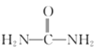 (l)+H2O(g) △H=-159.5kJ·mol-1+116.5kJ·mol-1=-43kJ·mol-1,故答案为:2NH3(g)+CO2(g)
(l)+H2O(g) △H=-159.5kJ·mol-1+116.5kJ·mol-1=-43kJ·mol-1,故答案为:2NH3(g)+CO2(g)![]()
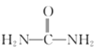 (l)+H2O(g) △H=-43kJ·mol-1;
(l)+H2O(g) △H=-43kJ·mol-1;
②根据反应ⅰ和反应ⅱ分析,提高氨碳比[![]() ,有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率,故答案为:有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率;
,有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率,故答案为:有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率;
(2)①如图所示,10min时,n(CO2)=0.24mol,则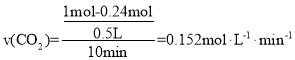 ,故答案为:
,故答案为:![]() ;
;
②根据图示知,反应ii反应慢,则合成尿素总反应进行到55min时到达平衡,故答案为:55;
③合成尿素总反应的平衡常数为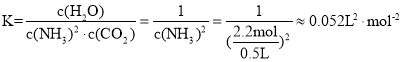 ,故答案为:
,故答案为:![]() ;
;
(3)①电极B上生成氢气,H元素化合价减低,得电子发生还原反应,所以B电极为阴极,故答案为:阴;
②A电极上CO(NH2)2转换生成N2,N化合价升高,失去电子,作为阳极,电极反应为:
CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+,故答案为:CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+。


科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
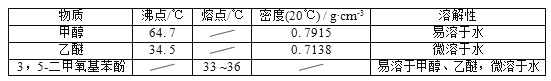
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是
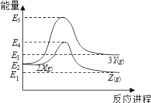
A.由X→Z反应的ΔH=E2-E1
B.反应2X(g) = 3Y(g)的活化能=E3-E2
C.2X(g) = Z(s) ΔH<E1-E2
D.由图可知,X(g)、Y(g)、Z(g)的稳定性情况为:Z(g)>X(g)>Y(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钇主要用于制造微波磁性材料、军工材料、光学玻璃和显像管涂料等。工业上通过如下工艺流程用钇矿石(Y2 FeBe2 Si2O10,Y的化合价为+3)制取氧化钇。

已知:i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)用氧化物的形式表示Y2 FeBe2 Si2O10为___, 钇矿石在熔融前要粉碎,目的是___。
(2)共熔时通人氧气的作用是_________。
(3)滤液I中溶质的主要成分是___ ( 假设钇矿石恰好与NaOH完全反应)。
(4)用氨水调节pH=a时,a的取值范围是_____,设计实验证明滤渣I沉淀完全: _______________。
(5)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
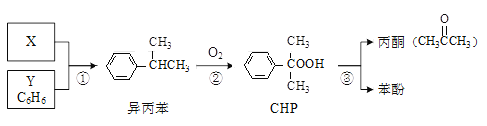
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是
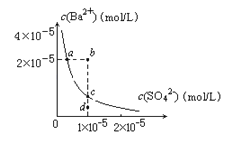
A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素锰(Mn)在溶液中主要以Mn2+(近无色)、MnO4-(紫红色)、MnO42-(绿色)等形式存在,MnO2(棕黑色)、MnCO3(白色)为难溶于水的固体。回答下列问题:
(1)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法推算。现根据下列3个热化学反应方程式:
①MnO2(s)+CO(g)=MnO(s)+CO2(g) H=﹣150.6kJ/mol
②Mn3O4(s)+CO(g)=3MnO(s)+CO2(g) H=﹣54.4kJ/mol
③3Mn2O3v+CO(g)=2Mn3O4(s)+CO2(g) H=﹣142.3kJ/mol
写出CO气体还原MnO2固体得到Mn2O3固体和CO2气体的热化学反应方程式:_________
(2)①一定温度下,在5L的密闭容器中放入足量碳酸锰(固体所占体积忽略不计)发生反应:MnCO3(s)![]() MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
②保持温度不变,若t0时刻达到平衡时,CO2浓度为cmol/L;t1时刻,将容器体积缩小为原来的一半并固定不变,在t2时刻再次达到平衡,则下列图像正确的是_____(填字母)。

(3)已知Fe3+、Al3+、Mn2+的氢氧化物开始沉淀及沉淀完全时的pH如下表所示,当Al3+完全沉淀时,若要使Mn2+不沉淀,则Mn2+的最大浓度为_______________。(已知:Ksp[Mn(OH)2] = 1.9×1013)
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 |
完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+==Mn2++4H2O
MnO4-+3e-+2H2O==MnO2↓+4OH-;
MnO4-+e-==MnO42-
①从上述三个半反应中可以得出的结论是_______________。
②将SO2通入高锰酸钾溶液中,观察到的现象是________。
(5)向酸性高锰酸钾溶液中加入草酸溶液,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是_______________,写出反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
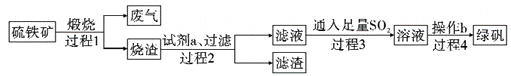
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘量法测定废水中硫化物的实验装置如图所示。
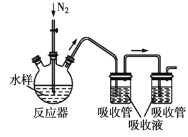
Ⅰ.取样、吹气、固硫
按右图连接好装置,检查气密性。取足量的醋酸锌吸收液于两支吸收管中,取100mL水样于反应器中,通入氮气一段时间后,向反应器中加入10mL盐酸,![]() 加热,反应后继续通入氮气。
加热,反应后继续通入氮气。
已知:废水中的硫化物在酸性条件下易转化为剧毒的硫化氢,醋酸锌可用于完全吸收硫化氢生成硫化锌沉淀。回答下列问题:
(1)图中反应器的名称是________,反应后继续通入氮气的目的是________,反应器加热温度不能高于![]() 的原因是________。
的原因是________。
Ⅱ.滴定、分析
关闭氮气后,往两支吸收管中各加入![]() 的碘标准溶液50mL(过量),静置。加入淀粉指示液,用
的碘标准溶液50mL(过量),静置。加入淀粉指示液,用![]() 的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定,共消耗
的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定,共消耗![]() ,溶液
,溶液![]() 。
。
(2)加入碘标准溶液时吸收管中发生反应的化学方程式为________。
(3)滴定终点的现象为________。
(4)废水中硫的含量为________![]() 。若只使用一支吸收管,可能致测定结果偏________(填“高”或“低”。)
。若只使用一支吸收管,可能致测定结果偏________(填“高”或“低”。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com