
NA表示阿伏加德罗的值,下列有关说法正确的是
A.标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA
B.常温常压下,16g14CH4所含中子数数目为8NA
C.15.6gNa2O2和水完全反应转移的电子数为0.2NA
D.0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中可能大量共存的是
①无色透明溶液中:K+、Ca2+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、 [Al(OH)]4-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-) =10-4mol·L-1的溶液中:NH4+、Al3+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、Cl-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①②④ B.③⑥ C.②④ D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:选择题
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
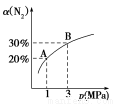
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:选择题
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4 kJ/mol B.-45.2kJ/mol C.+69.4 kJ/mol D.+45.2 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:实验题
某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
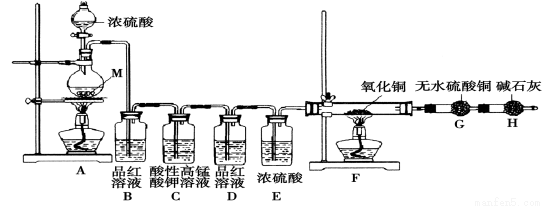
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式: ;
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。试写出烧瓶里发生反应的总化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:实验题
(一)如图所示,甲、乙是电化学实验装置,请回答下列问题:
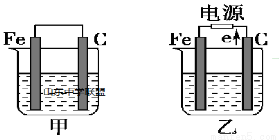
若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是_________________________________
②乙中总反应的离子方程式为___________________________________
③若乙中含有0.10 mol·L-1NaCl溶液400mL,当阳极产生的气体为560mL(标准状况下)时,溶液的pH=_____________(2分)(假设溶液体积变化忽略不计),转移电子的个数为____________
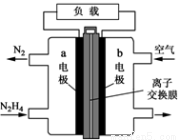
(二)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景。其工作原理如上图所示,回答下列问题:
①该燃料电池中正极通入的物质是__________;
负极发生的反应式为:__________________________
②电池工作时,OH- 移向极________(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼________g
(三)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42﹣.电池放电时,负极的电极反应为:V2+﹣e﹣=V3+.
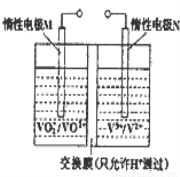
①电池放电时的总反应方程式为___________________________
充电时,电极M应接电源的_________ 极
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前 需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+)_________ _(填“增大”、“不变”或“减小”) (1分),阳极的电极反应式为_________________________
_(填“增大”、“不变”或“减小”) (1分),阳极的电极反应式为_________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:选择题
下列热化学方程式正确的是
A.2SO2+O22SO3 ;H =-196.6 kJ·mol-1
B.H2 (g)+1/2O2 (g) = H2O(l);H =-285.8 kJ·mol-1
C.2H2 (g)+O2 (g) = 2H2O(l);H =-571.6 kJ
D.C(s)+O2 (g) = CO2 (g);H = +393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是( )[来
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com