
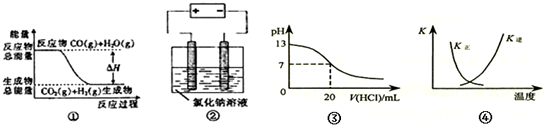
| A. | 图①表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)中的△H大于0 | |
| B. | 图②是石墨为电极电解氯化钠稀溶液,阴、阳两极产生气体体积之比一定为1:1 | |
| C. | 图③表示25℃,0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,pH随加入酸体积的变化 | |
| D. | 图④表示2SO2(g)+O2(g)?2SO3(g)△H<0 正、逆反应平衡常数K随温度的变化 |
分析 A、图象中反应物能量高于生成物能量,反应前后能量守恒;
B、惰性电极电解氯化钠稀溶液,发生的反应先为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;后为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,根据化学方程式计算分析判断;
C、酸碱中和的时候pH会突变;
D、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小.
解答 解:A、图象中反应物能量高于生成物,反应为放热反应,△H<0,故A错误;
B、惰性电极电解电解氯化钠稀溶液发生的反应先为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;后为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑;阴极生成单质为氢气,阳极生成单质先析出氯气,后析出O2;一定时间内,两电极产生单质的物质的量之比不一定为1:1,故B错误;
C、用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故C错误;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故D正确;
故选:D.
点评 本题以图象与中和滴定、化学平衡、能量变化、电解池等知识,题目难度中等,注意抓住图象的“形变神不变”对图象进行分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 验证淀粉水解产物时,在淀粉溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量的金属钠 | |
| C. | 向2mLl0%NaOH溶液中滴入2%CuS04溶液的4-6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有砖红色沉淀出现 | |
| D. | 植物油能使溴的四氯化碳溶液褪色,盛过油脂的试管用碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
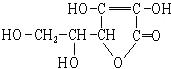
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
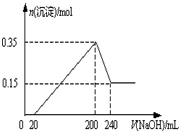 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com