
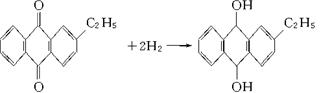
(1)涉及还原反应的方程式可写成________________________。
涉及氧化反应的方程式可写成________________________。
(2)“绿色化学”是当今社会人们提出的一个新概念,“绿色化学”工艺中原子利用率为100%。试问该法生产H2O2可否成为理想状态的“绿色化学工艺”?___________(填“是”或“不是”),简述理由__________________________________________________________________。
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

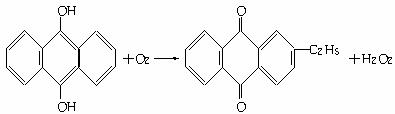
回答:
(1)上述反应中涉及氧化反应的方程式为_________________________________________。涉及还原反应的方程式为___________________________________________________。
(2)“绿色化学”是当今社会提出的一个新概念。在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:
原子利用率=期望产物的总质量与生成物的总质量之比
如:CH2=CH2+Cl2+Ca(OH)2![]()
![]() +CaCl2+H2O,则制备
+CaCl2+H2O,则制备![]() 工艺的原子利用率为
工艺的原子利用率为![]() ×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。_____________________________________________________________________
×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用乙基蒽醌制备H2O2,其工艺流程简单表示如下:
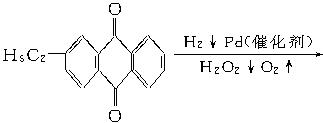
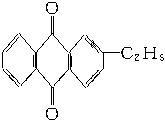
回答:
(1)上述反应中涉及氧化反应的方程式为__________________________________________。涉及还原反应的方程式为________________________________________________________。
(2)“绿色化学”是当今社会提出的一个新概念。在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:
原子利用率=期望产物的总质量与生成物的总质量之比
如:CH2====CH2+Cl2+Ca(OH)2![]()
![]() +CaCl2+H2O,则制备
+CaCl2+H2O,则制备![]() 工艺的原子利用率为
工艺的原子利用率为![]() ×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
查看答案和解析>>
科目:高中化学 来源:09-10年寿宁南阳高中高二下学期末考试化学卷 题型:选择题
“绿色化学”是当今社会人们提出的一个新概念,“绿色化学”工艺中原子利用率为100%。工业上可用乙基蒽醌(A)经两步反应制备H2O2,其反应可简单表示如下(条件省略):
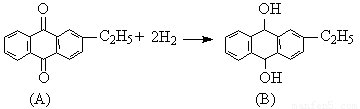

下列有关说法不正确的是 ( )
A.上述工业生产消耗的原料是H2、O2和乙基蒽醌
B.该法生产H2O2符合“绿色化学工艺”的要求
C.乙基蒽醌(A)的作用相当于催化剂,化合物(B)属于中间产物
D.第1反应中乙基蒽醌(A)发生还原反应,第2个反应中化合物(B)发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com