
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:21教育名师原创作品
(1)五种元素中,原子半径最大的是 Na ,非金属性最强的是 Cl (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 PH3 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 NH4Cl ,其中存在的化学键类型为 离子键和共价键 ;
(4)D最高价氧化物的水化物的化学式为 H3PO4 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 2P+5Cl2 2PCl5 ;D在不充足的E中燃烧,生成的主要产物的化学式为 PCl3 ;
(6)单质E与水反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(1)Na Cl (2)PH3 (3)NH4Cl 离子键和共价键 (4)H3PO4 (5)2P+5Cl2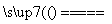 2PCl5 PCl3 (6)Cl2+H2O===H++Cl-+HClO
2PCl5 PCl3 (6)Cl2+H2O===H++Cl-+HClO
解析:根据题目所给的信息,A和B、D、E均可以形成共价型化合物,可知A是H元素,B是N元素(AB形成化合物的水溶液显碱性),C是Na元素,D是P元素,E是Cl元素。(1)根据原子半径变化规律,可知Na的原子半径最大;Cl的非金属性最强;(2)H与N、P、Cl形成的氢化物NH3、PH3、HCl,PH3最不稳定(P的非金属性最弱);(3)AE形成的化合物是HCl,A和B形成的化合物是NH3,二者反应的到的盐是NH4Cl,NH4Cl中存在的化学键是离子键和共价键;(4)P的最高价是+5价,最高价氧化物水化物的化学式为H3PO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.汽油、煤油和植物油均属于烃
B.有机物完全燃烧的产物只有CO2和H2O
C.乙醇、乙酸和乙酸乙酯均能与饱和Na2CO3溶液反应
D.C3H7Cl有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是( )

A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
两种微粒含有相同的质子数和电子数,这两种微粒可能是( )
①两种不同的原子 ②两种不同元素的原子 ③一种原子和一种分子 ④一种原子和一种离子 ⑤两种不同分子 ⑥一种分子和一种离子 ⑦两种不同阳离子 ⑧两种不同阴离子 ⑨一种阴离子和一种阳离子www-2-1-cnjy-com
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.按系统命名法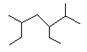 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.氨基酸常温下为固体,其熔点高的主要原因是分子间存在氢键
C.某烃完全燃烧时产生的n(H2O)>n(CO2),是其肯定属于烷烃
D.取等质量的乙烯和聚丙烯分别燃烧,它们的耗氧量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.第一电离能越小的元素其单质金属活泼性一定越大
B.电负性越小的元素金属性一定越强
C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键
D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,错误的是
A、化学反应必然伴随发生能量变化
B、化学反应中的能量变化主要是由化学键变化引起的
C、化学反应中能量变化的大小与反应物的质量多少无关
D、能量变化是化学反应的基本特征之一
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
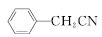 +H2O+H2SO4
+H2O+H2SO4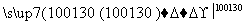
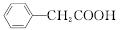 +NH4HSO4
+NH4HSO4
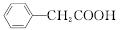 | |||
 | |||
+Cu(OH)2―→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
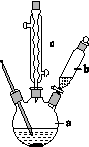
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com