
| A. | 蛋白质 | B. | 糖类 | C. | 维生素 | D. | 油脂 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mo l CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的 浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
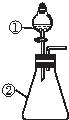 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选項 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氢氧化钠稀溶液 | 硫酸铝铵溶液 | 立即产生白色沉淀 |
| B | 氢氧化钠浓溶液 | 用砂纸打磨过的镁条 | 立即产生大量无色气体 |
| C | 浓硫酸 | 铜粉 | 立即产生刺激性气味气体 |
| D | 盐酸 | 较浓的硝酸亚铁溶液 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
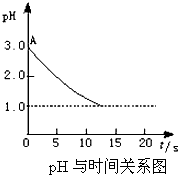 某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:
某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气是 理想的洁净能源 | |
| B. | 燃烧天然气产生的有害废气比氢气少 | |
| C. | 用天然气作燃料可解决温室效应问题 | |
| D. | 天然气、沼气的主要成分都是CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L CuCl2溶液中含有的Cl-的个数为2NA | |
| B. | 16 g甲烷中含有的共用电子对数为NA | |
| C. | 常温常压,46 gNO2与N2O4的混合气体中含有的原子数为3NA | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com