
| A. | 甲基橙 | B. | 石蕊 | C. | 酚酞 | D. | 任选一种均可以 |
分析 指示剂的选择原则:指示剂选择不当,加之肉眼对变色点辨认困难,都会给测定结果带来误差.因此,在多种指示剂中,选择指示剂的依据是:要选择一种变色范围恰好在滴定曲线的突跃范围之内,或者至少要占滴定曲线突跃范围一部分的指示剂;
强碱滴定强酸或者强酸滴定强碱,可以选用酚酞或者甲基橙;
强酸滴定弱碱,中和后得到溶液为强酸弱碱盐,溶液呈酸性,选择甲基橙做指示剂;
强碱滴定弱酸,中和后得到溶液为强碱弱酸盐,溶液呈碱性,选择酚酞做指示剂.
解答 解:强碱滴定强酸或者强酸滴定强碱,可以选用酚酞或者甲基橙;
强酸滴定弱碱,中和后得到溶液为强酸弱碱盐,溶液呈酸性,选择甲基橙做指示剂;
强碱滴定弱酸,中和后得到溶液为强碱弱酸盐,溶液呈碱性,选择酚酞做指示剂;
硫酸与氨水发生中和反应生成硫酸铵,为强酸弱碱盐,溶液显酸性,应选择甲基橙做指示剂,
故选:A.
点评 本题考查了中和滴定实验指示剂选择,明确中和滴定原理,熟悉中和指示剂选择原则是解题关键,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | m+n>p | B. | A 的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: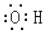 | ||
| C. | 苯酚的结构简式为C6H5OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
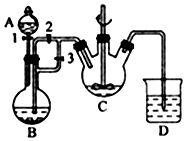 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
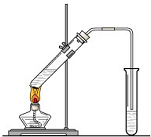 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com