
| A、向饱和的食盐水中通气体的最合适的方法是先通CO2,再通NH3 |
| B、该反应能发生的原因是NaHCO3的溶解度在几种物质中最小 |
| C、若制得的”碱“中混有少量的NaHCO3,应用过量的NaOH溶液除去 |
| D、用酚酞试液可鉴别制得”碱“液和NaHCO3溶液 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液中:c(Cl-)+c(H+)=c(NH4+)+c(OH-)+2c(NH3.H2O) |
| B、Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX)+c(H+) |
| D、pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、s能级的能量总是小于p能级的能量 |
| B、2s的电子云比1s的电子云大,说明2s的电子云中的电子比1s的多 |
| C、当电子排布在同一能级的不同轨道时,电子总是先占满1个轨道,然后再占据其他原子轨道 |
| D、nf能级中最多可容纳14个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
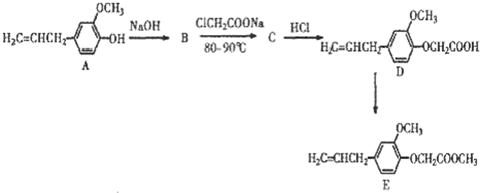
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n[CO]/mol | n[H2O]/mol |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 | x |
| 4 | y | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1molNO2在反应中转移的电子为4mol |
| D、CO2既不是氧化产物,也不是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
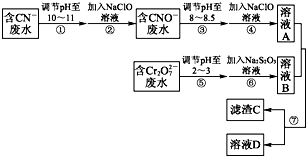
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com