
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:不详 题型:填空题
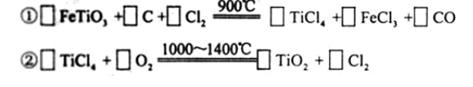
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢笔的笔头不易被氧化,抗腐蚀性能好 |
| B.铱金笔的耐磨性能比钢笔要好 |
| C.铱金笔的笔头和笔尖都是用纯金制成的 |
| D.铱金笔经久耐磨,书写时弹性特别好,是一种理想的硬笔 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2NaCl(熔融)通电2Na+Cl2↑ | B.MgO+H2△Mg+H2O |
| C.Fe3O4+4CO高温3Fe+4CO2 | D.2HgO△2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电能是一级能源 | B.水力是二级能源 |
| C.天然气是一级能源 | D.焦炉气是一级能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
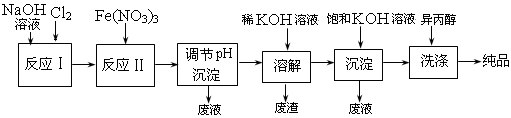
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
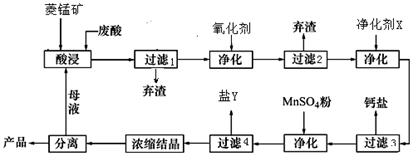
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
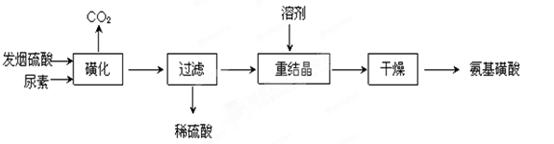
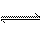 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 材料 | 主要化学成分 |
| A. | 陶瓷餐具 | 硅酸盐 |
| B. | 计算机芯片 | 晶体硅 |
| C. | 合金钢 | 铁碳铬硅等合金 |
| D. | 金刚砂 | 二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com