
| A. | H2SO4和HNO3都属于酸 | B. | Na2CO3和Na2O都属于盐 | ||
| C. | NaOH 和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
分析 电离时生成的阳离子全部是氢离子的化合物叫酸;
电离时生成的阴离子全部是氢氧根离子的化合物叫碱;
电离时生成金属离子和酸根离子的化合物叫盐;
由两种元素组成其中一种是氧元素的化合物叫氧化物;
据定义分析即可.
解答 解:A、H2SO4和HNO3水溶液中电离出的阳离子全部是氢离子的化合物都属于酸,故A正确;
B、Na2CO3是金属阳离子和酸根阴离子构成属于盐,Na2O是两种元素组成其中一种为氧元素属于氧化物,故B错误;
C、NaOH水溶液中电离出的阴离子全部是氢氧根离子的化合物属于碱,Na2CO3属于盐,故C错误;
D、Na2O属于氧化物,Na2SiO3属于盐,故D错误;
故选A.
点评 本题考查了酸、碱、盐、氧化物的概念,难度不大,注意这几个概念的区别.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH与CH3CH2OCH3 | B. |  与 与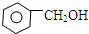 | ||
| C. | CH3COOH与HCOOCH2CH3 | D. | CH3CH2CH2CHO与(CH3)2CHCH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BiONO3 | B. | (NH4)2Fe(SO4)2 | C. | Ca(ClO)Cl | D. | K3Fe(CN)6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6LH2O含有的分子数为0.25NA | |
| B. | 常温常压下,1.06gNa2CO3含有Na+离子数为0.02NA | |
| C. | 通常情况下,NA个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2中含有的电子数为2NA | |
| B. | 22.4L氧气所含的氧原子数为2NA | |
| C. | 常温常压下,28g氮气所含的原子数为NA | |
| D. | 2g氢气所含的氢原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收29.2kJ热量 | B. | 放出29.2kJ热量 | C. | 放出7.3kJ热量 | D. | 吸收7.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g Fe粉与足量的稀硝酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com