
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2
③SiHCl3与过量H2在1 100 ℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_____。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
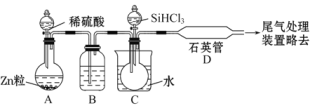
①装置B中的试剂是_____,装置C中的烧瓶需要加热,其目的是______。
②反应一段时间后,装置D中观察到的现象是____,装置D中发生反应的化学方程式为____。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是____(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
【答案】SiO2+2C![]() Si+2CO↑ 蒸馏 浓硫酸 使滴入烧瓶中的SiHCl3气化 有固体物质生成 SiHCl3+H2
Si+2CO↑ 蒸馏 浓硫酸 使滴入烧瓶中的SiHCl3气化 有固体物质生成 SiHCl3+H2![]() Si+3HCl 排尽装置中的空气 bd
Si+3HCl 排尽装置中的空气 bd
【解析】
本实验是利用SiHCl3和氢气反应制取纯硅,首先在装置A利用稀硫酸和锌粒反应制取氢气,SiHCl3能与H2O强烈反应、在空气中易自燃,所以需要装置B中盛放浓硫酸将生成的氢气进行干燥、并用氢气排尽装置中的空气;水浴加热装置C,使SiHCl3挥发,和氢气一同进入石英管中在高温条件下反应制取纯硅。
(1)高温下,SiO2和C反应生成Si和CO,反应的化学方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)沸点不同的液体混合物可以采用蒸馏的方法分离,这几种物质沸点不同,所以采用蒸馏的方法分离;
(3)①为防止SiHCl3与H2O强烈反应,需要干燥剂干燥氢气,浓硫酸具有吸水性且不和氢气反应,所以装置B中可以盛放浓硫酸;加热装置C中烧瓶,升高温度能使SiHCl3气化,从而使SiHCl3和氢气在D中反应;
②D中发生反应SiHCl3+H2![]() Si+3HCl,Si为固态,所以看到的现象是有固体物质生成;
Si+3HCl,Si为固态,所以看到的现象是有固体物质生成;
③SiHCl3能与H2O强烈反应、在空气中易自燃,且Si是亲氧元素,为防止SiHCl3自燃和Si被氧化,需要排尽装置中的空气;
④若含铁单质,加入稀盐酸后溶液中应含Fe2+;检验Fe2+先加入KSCN溶液无明显现象,再加入氯水溶液变红色即可,故选b、d。


科目:高中化学 来源: 题型:
【题目】在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2、SO32
B.1.0mol·L1的KNO3溶液:H+、Fe2+、Cl、SO42
C.在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
D.通入足量CO2的溶液:Ca2+、Cl、K+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
A. 升高温度会使反应速率加快
B. 当NH3的浓度不再变化时,反应达到了平衡状态
C. 在高温和催化剂作用下,H2可以100%地转化为NH3
D. 使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
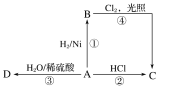
(1)写出A、B、C、D的结构简式:A___,B___,C__,D__。
(2)写出②④两步反应的化学方程式,并注明反应类型:
②___,反应类型:___。
④___,反应类型:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一。它可由两步反应生成。
①邻羟基苯甲醛在一定条件下生成邻羟基苯甲酸;
②邻羟基苯甲酸与 CH3COCl 反应生成阿司匹林。
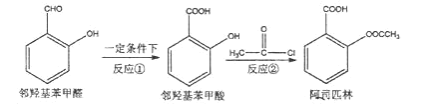
下列说法正确的是( )
A.反应①可使用酸性 KMnO4 溶液作氧化剂
B.反应②的另一产物是 HCl
C.1mol 阿司匹林最多可以和 2molNaOH 反应
D.邻羟基苯甲醛分子中在同一平面上的原子最多为 12 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的方程式(必要时注明反应条件)
(1)实验室制备氯气的化学反应方程式 _______________。
(2)乙醇催化氧化反应(铜作催化剂)_______________。
(3)苯与浓硝酸反应____________________。
(4)CH3CH=CH2发生加聚反应___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。
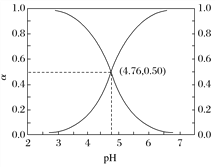
下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com