
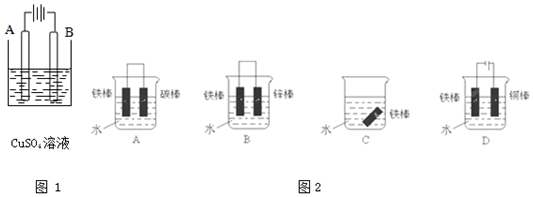
���� ��1���ٵ��ʱ���Ʋ����Ϊ�������Ƽ�����Ϊ������
���ڶ�ͭ�������������������ʴ���ڶ�п���ĶƲ����������������������
��2����Ϊ���ý����������绯ѧ��ʴ����Ϊԭ��ظ���ʱ�������绯ѧ��ʴ������Ϊԭ��ص���������ӵ�Դ�ĸ������ɷ�ֹ��ʴ��
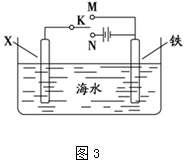
��3������XΪ̼��������Fe�Ƚϻ��ã�Ϊ�������ĸ�ʴ��ӦʹFe���ӵ�Դ�ĸ��������躣ˮ��ֻ��NaCl���ʣ����ʱ�����ӷ�Ӧ����ʽΪ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2����
����XΪп������K����M�����γ�ԭ��أ�ZnΪ��������ʴ��FeΪ������������
��� �⣺��1����ͼ1��Ҫ�������ı����ͭ������ͭΪ��������Ϊ��������B��Ϊ����������ԭ��Ӧ����ӦʽΪ��Cu2++2e-=Cu��AΪͭ������������Ӧ���缫����ʽΪCu-2e-=Cu2+���ʴ�Ϊ��ͭ��Cu2++2e-=Cu��
������ͭ���ã��γ�ԭ��ط�Ӧʱ����Ϊ������ͭΪ�������Ʋ������ͭ���ȶ�п�������ױ���ʴ����п�������ã��γ�ԭ��ط�Ӧʱ����Ϊ������пΪ�����������Ա��������ʴ�Ϊ����ͭ����
��2��A���γ�ԭ��ط�Ӧ����Ϊ������̼Ϊ������Ϊ����������ʴ����A����
B��п�������ã���Ϊ�����������������Ը�ʴ����B��ȷ��
C��ˮ���ܽ����������ɷ�����ʴ����C����
D�������ӵ�Դ������Ϊ����������������ʴ����D��ȷ��
�ʴ�Ϊ��BD��
��3������XΪ̼��������Fe�Ƚϻ��ã�Ϊ�������ĸ�ʴ��ӦʹFeΪ���ص���������K����N�������躣ˮ��ֻ��NaCl���ʣ����ʱ�����ӷ�Ӧ����ʽΪ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2�����ʴ�Ϊ��N�� 2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2����
����XΪп������K����M����ZnΪ��������ʴ��FeΪ�������������÷�������Ϊ����������������������������ӦΪ��O2+4e-+2H2O=4OH-���ʴ�Ϊ������������������������O2+4e-+2H2O=4OH-��
���� ���⿼��ԭ���֪ʶ�������ڽ����ĸ�ʴ������Ŀ��飬Ϊ��Ƶ���㣬ע�����ԭ��ء����صĹ���ԭ���Լ������ķ����������ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ 2Fe+6H+�T2Fe3++3H2�� | |
| B�� | ̼�������ϡ������ CO32-+2H+�TCO2+H2O | |
| C�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- | |
| D�� | ̼��������Һ�����ᷴӦ HCO3-+H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӻ�������һ�������ڹ��ۼ� | B�� | �ڵ��ʷ�����һ�����ڹ��ۼ� | ||
| C�� | ���ۼ�һ��ֻ�����ڹ��ۻ������� | D�� | �ڹ��۷�����һ�����ڹ��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ԭ��Ӧ�У�һ����һ��Ԫ�ر���������һ��Ԫ�ر���ԭ | |
| B�� | ��������Ԫ�صĻ��ϼ�Խ�ߣ������ʵ������Ծ�Խǿ | |
| C�� | HClO���������ԣ����л�ԭ�� | |
| D�� | 1molCl2�μӷ�Ӧת��2mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͨ©�� | B�� | ����©�� | C�� | ��Һ©�� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ�����淴Ӧ�����ƶ� | B�� | a��c+d | ||
| C�� | Z������������� | D�� | X��ת�����½� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaSO4 | B�� | NaHCO3 | C�� | NaCl | D�� | Na2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ˮ�м����л��ܼ���ȡ�⣬ֻ�ܴӷ�Һ©���¿ڷ����������л��� | |
| B�� | ����ϡ���������ɫ���壬ͨ��Ʒ����Һ����ɫ��ԭ��Һ��һ����CO32-��HCO3- | |
| C�� | ������ƿ����ʱ�����ӿ̶��ߵμ�����ˮ����������Һ�����ʵ���Ũ��ƫС | |
| D�� | ��������к͵ζ�ʱ���۾�Ҫʼ��ע�ӵζ���Һ��߶ȵı仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com