
分析 根据n=$\frac{m}{M}$计算agAl3+的物质的量,再根据$\frac{V}{4}$mL溶液中含有的Al3+的物质的量,根据化学式可知n(SO42-)=$\frac{3}{2}$n(Al3+),再根据c=$\frac{n}{V}$计算稀释后溶液中硫酸根离子的浓度.
解答 解:agAl3+的物质的量为:$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
取$\frac{V}{4}$mL溶液中含有Al3+的物质的量为:$\frac{1}{4}$×$\frac{a}{27}$mol,
故n(SO42-)=$\frac{3}{2}$n(Al3+)=$\frac{3}{2}$×$\frac{1}{4}$×$\frac{a}{27}$mol=$\frac{a}{72}$mol,
故稀释为4VmL后溶液的c(SO42-)=$\frac{\frac{a}{72}mol}{4V×1{0}^{-3}L}$=$\frac{125a}{36}$mol/L,
故答案为:$\frac{125a}{36}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,掌握物质的量浓度的表达式为解答关键,注意明确溶质化学式与含有离子之间量的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
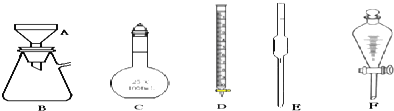
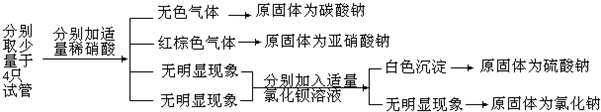 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
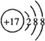 .
.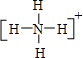 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.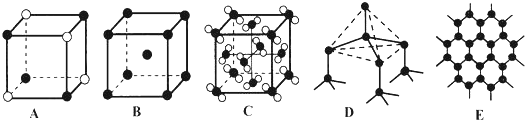
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH3CH2OH | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
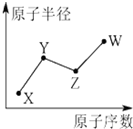 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示: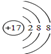 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液时,将硝酸银溶液逐滴滴入氨水中 | |
| B. | 乙醇中混有乙酸,加蒸馏水,然后分液 | |
| C. | 苯中混有苯酚,加浓溴水,然后分液 | |
| D. | 溴苯中混有溴,加NaOH溶液,然后分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com